Stoffgemische
Viele der uns umgebenden Stoffe sind Gemische aus mehreren Substanzen. Meerwasser ist beispielsweise eine Mischung aus Wasser und Salzen, ja im Meerwasser sind viele Salze gelöst. Wirbelt man Staub auf, müsste man diese Mischung in der Luft eigentlich Rauch nennen , aber das tut keiner. Ein Eintopf mit vielen Stücken Gemüse und/oder Fleisch würde in der Fachsprache „Aufschlämmung“ heißen. Aber verlange mal einen Nachschlag von der leckeren „Aufschlämmung„…
Wir nutzen das äußere Erscheinungsbild und die Aggregatzustände der vermischten Stoffe, um die Stoffgemische zu benennen und zu klassifizieren.
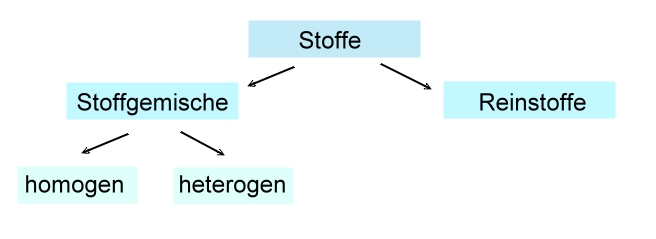
Enthalten Gemische äußerlich auch mikroskopisch unterscheidbare Schichten(Phasen) oder Bereiche, so nennen wir sie „heterogen„. Sind die vermischten Stoffe nach außen jedoch nicht zu unterscheiden – wie in Meerwasser – so nennt man das Gemisch „homogen“.

( ø bis 30 µm , hier vergrößert dargestellt) sind unterschiedlich groß und neigen dazu, sich zu großen Tropfen zu vereinigen. Das Stoffgemisch Milch trennt sich. Es „rahmt auf“ oder „demulgiert“, sagt man. Presst man die Milch jedoch unter Hochdruck durch schmale Düsen oder spritzt sie mit hohem Druck auf Metallplatten, so entstehen in der Milch nur noch winzig kleine Fetttropfen
(ø = 1µm), die die Neigung zu Vereinigung kaum noch besitzen. Somit bleibt die Milch länger im emulgierten Zustand. Diesen Vorgang, bei dem die Milch nach außen weniger unterschiedliche Teilchen aufweist, nennt man „Homogenisieren„.
Auch die metallischen Werkstoffe (Legierungen) werden homogenisiert. Dazu wird das sogenannte Lösungsglühen durchgeführt.
Die speziellere Unterscheidung in die einzelnen Arten von Stoffgemischen geschieht durch die folgende Zuordnung:
„[Aggregatzustand] des beigemischten Stoffes \( \rightarrow \) [Aggregatzustand] des Hauptbestandteil des Gemisches“
Beispiel:
Salzwasser: [fest ]Salz \( \rightarrow \) [flüssig] Wasser …(fest in flüssig)
| beigemischter Stoff in \( \longrightarrow \) | Hauptbestandteil fest | Hauptbestandteil flüssig | Hauptbestandteil gasförmig |
| beigemischter Stoff fest | Gemenge (locker vermischt) (Hülsenfrüchte)  Legierung (innig vermischt) (verschmolzen) (Bronze)  | Lösung (lösliche Beimischung) (Meerwasser)  Aufschlämmung(1) (nicht lösliche Beimischung) (Eintopf)  | Rauch(2) (Weihrauch)  (Vulkanasche)  |
| beigemischter Stoff flüssig | (Teig) | Lösung (lösliche Beimischung) (Säfte ohne Fruchtfleisch)  Emulsion (nicht lösliche Beimischung) (Milch)  | Nebel (2)  (Sprühwolke)  |
| beigemischter Stoff gasförmig | Hartschaum (Schaumstoff)  (Gasbeton)  | Lösung (lösliche Beimischung)  Schaum (nicht lösliche Beimischung)  | Gasgemisch (Luft)  (Schweißgas)  |
Hier die Kurzdefinitionen der wichtigsten Gemische:
Homogene Gemische:
Legierung: inniges Gemisch unterschiedlicher Metalle, die miteinander verschmolzen sind
Lösung: Feststoff, Flüssigkeit oder Gas homogen in einer Flüssigkeit verteilt
Gasgemisch: Gemisch mehrerer Gase
Heterogene Gemische:
Gemenge: lockeres Gemisch mehrerer nicht-mischbarer Feststoffe
Emulsion: Gemisch mehrerer nicht-mischbarer Flüssigkeiten
Nebel: Flüssigkeit verteilt in einem Gas
Rauch: Feststoff verteilt in einem Gas
Schaum: Gas verteilt in einer Flüssigkeit
Hartschaum: Gas verteilt in einem Feststoff
Stoffgemische—Stoffgemischarten und Begriffe
liveworksheets.com
Hier findest du die Erklärungen für die Gemischarten
liveworksheets.com
Arbeitsblatt: Stoffgemische interaktiv 2— Art – Erklärung zuordnen
![]()