Chemie im Haushalt

Arbeitsblätter zum Thema:
Im folgenden Video wird noch einmal die Bandbreite der verwendeten Chemikalien deutlich…
sicherer Umgang mit Chemikalien im Haushalt:
![]()
Chemie kann man üben!


Arbeitsblätter zum Thema:
Im folgenden Video wird noch einmal die Bandbreite der verwendeten Chemikalien deutlich…
sicherer Umgang mit Chemikalien im Haushalt:
![]()

Sprechen wir von Salz, so meinen wir im täglichen Sprachgebrauch fast immer Speise– oder Kochsalz. Natriumchlorid heißt dieses Salz in der Chemie. Es ist das Natriumsalz der Salzsäure oder Chlorwasserstoffsäure.
Seine Formel lautet NaCl, es bildet farblose, feste würfelförmige Kristalle, die uns weiß erscheinen, wenn sie durch Zerkleinern Risse beinhalten.
Kochsalz löst sich gut in Wasser (36g/100ml), ist geruchlos und nicht brennbar.
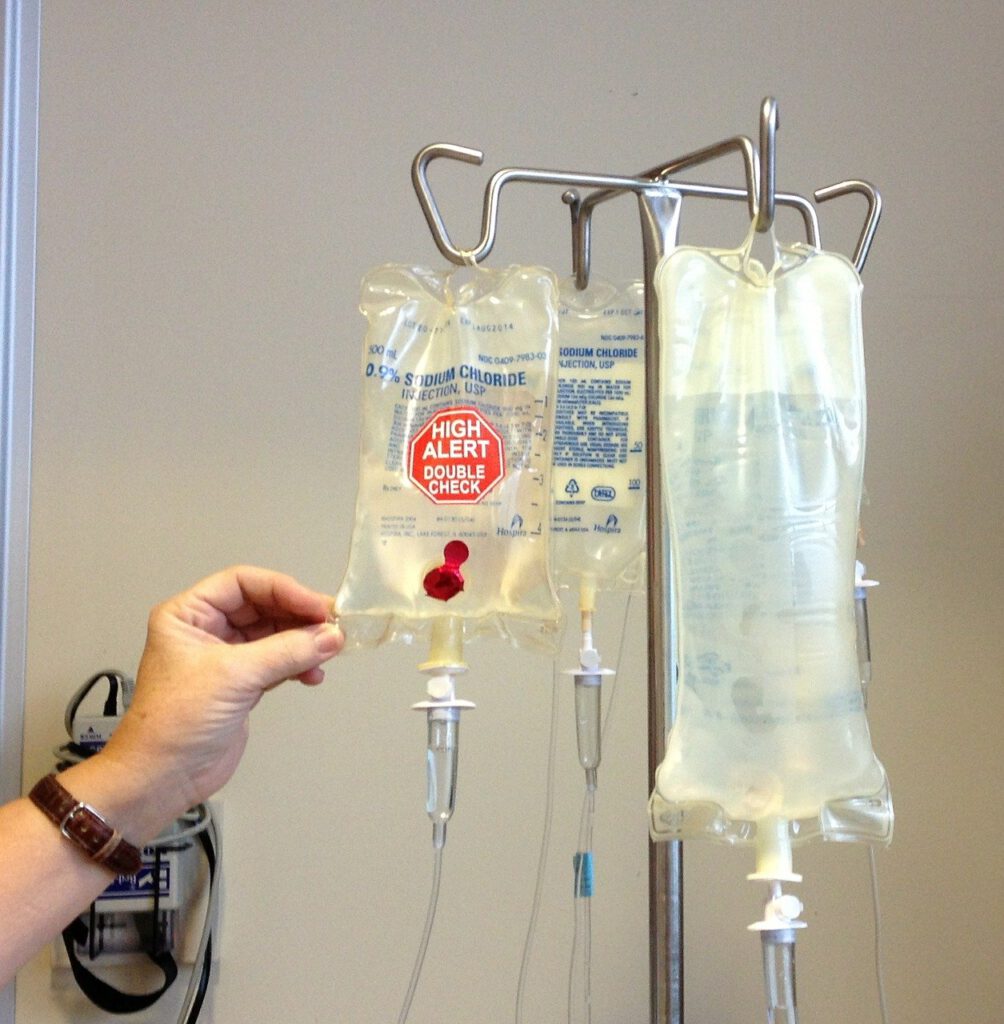
Wir benötigen ca. 5g Salz am Tag. Wir nutzen Salz zum Würzen unserer Speisen, zur Konservierung von Nahrung und auch zur Enteisung von Straßen im Winter. In medizinischen Präparaten dient es als 0,7% Lösung als kurzzeitiger Blutersatz zur Kreislaufstabilisierung.





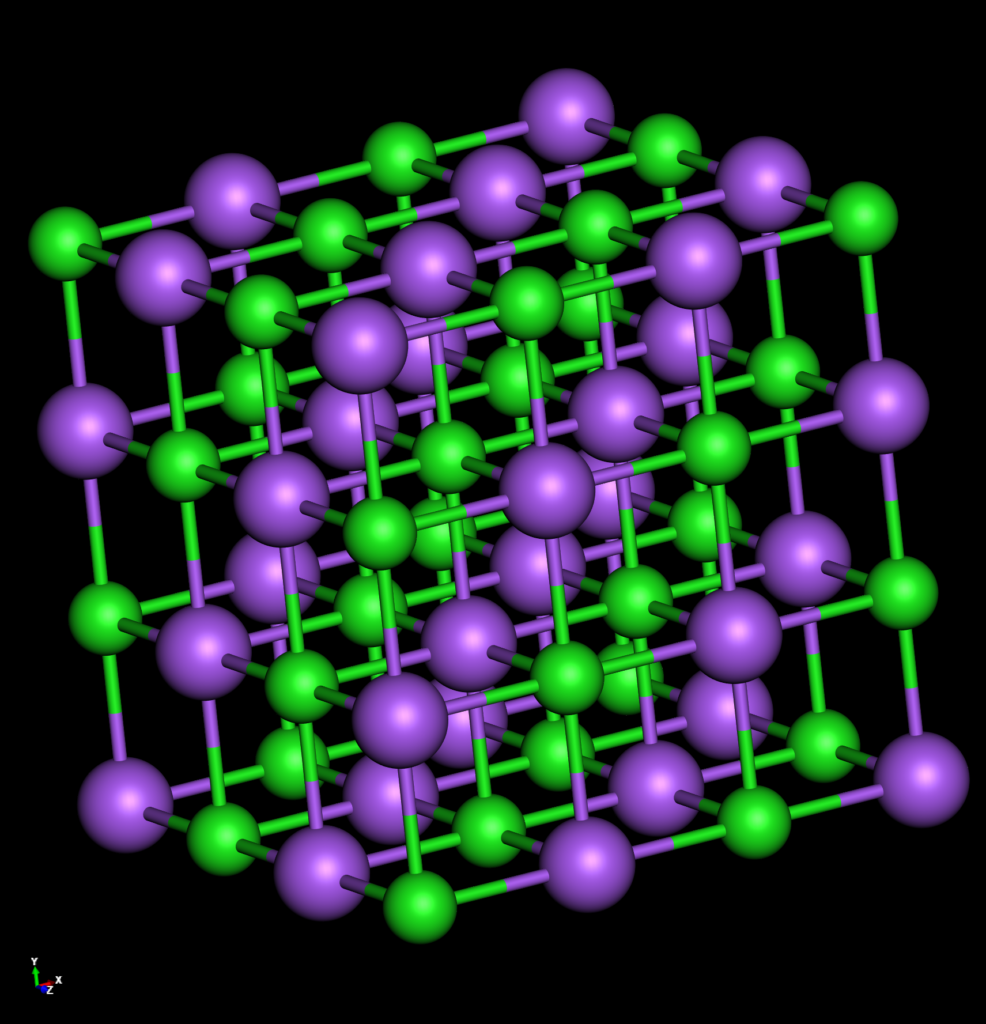
Der Bau von Salz
Salz bildet einen Ionenkristall. Seine Bestandteile sind die Ionen der Elemente Natrium und Chlor. Das positiv geladene Natriumion ist in allen Richtungen (rechts, links, vorn, hinten, oben, unten) von negativ geladenen Chloridionen umgeben. Die Ionen halten durch die vorhandenen Anziehungskräfte (positiv/negativ) und die nebenbei auch entstehenden Abstoßungskräfte einen konstanten Abstand zueinander. Das Mineral NaCl heißt „Halit“ (engl. Halite). und bildet würfelförmige Kristalle, die farblos sind.
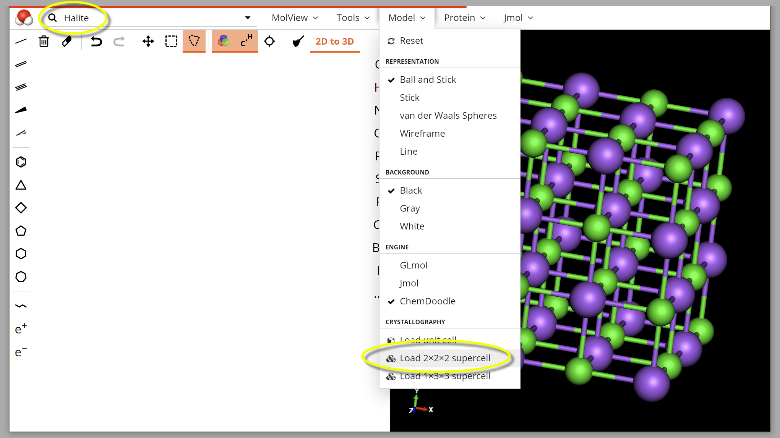
Für eine animierte Version dieser Darstellung gehen Sie folgendermaßen vor:
Geben Sie auf www.molview.org in die Suchzeile „Halite“ein und stellen Sie unter „Model“ die „2x2x2 Celle“ aus.
Das Auflösen von Salz im Wasser
►als Video , Salz lösen (von www.chemie-interaktiv.net)
Wassermoleküle sind ständig in Bewegung. Sie sind sogenannte Dipole. Das bedeutet, ihre Moleküle besitzen positive und negative Ladungsschwerpunkte, die Anziehungskraft auf entgegengesetzt geladene Teilchen ausüben. Das macht Wasser zu einem hervorragenden Lösungsmittel.
Und das immer nach dem gleichen Schema:
1. Die Wassermoleküle dringen in den Ionenkristall ein.
2. Die Kräfte zwischen den Ionen im Gitter werden durch die Ladungs- und Abstandsveränderungen geschwächt.
3. Die Wassermoleküle umlagern die Ionen.
4. Die umlagerten Ionen werden – dank der Eigenbewegung von Wasser- abtransportiert.
Dieser Prozess verläuft endotherm:
Der folgende Inhalt stammt von www.javalab.org
Der „Eis- Salz – Wasser“ Kühlschrank:
Experiment zu „Salze im Lösungsprozessen“ – mit Deutung der Ergebnisse
Arbeitsblätter zum Thema Salz auch im Arbeitsmaterial Klasse 9 :




mehr zum Thema Salz:
Lernprogramm Salz (PC – Download)
Lernbox Salz der Uni Bremen ( Chemie Didaktik )
![]()
Salzgewinnung aus dem Meer:
Die Salzfarm im Gebirge:
Entstehung unterirdischer Vorkommen:
Salzgewinnung aus der Erde:
Oder man fördert eine Salzlösung -Sole genannt – und dampft diese ein…
Salzsieder waren angesehene Handwerker. Salinen und Sudhäuser verweisen in unserem Land deutlich auf diese alte traditionsreiche Art, Salz zu gewinnen. Überall wurde salzhaltiges Wasser – Sole – zutage gefördert und dort „gesiedet“. Heute wird heißes Wasser in die Erde gepumpt und löst dort das mit Gestein vermischte Salz. Wieder zutage geholt, kann das Salz durch Eindampfen der Sole gewonnen werden.
Sehr umfangreich
![]()
![]()
Heute bestellen wir Ware online. Das war vor 1000 Jahren undenkbar.
Damals produzierte man Waren und tauschte sie in der nächsten Ortschaft oder beim fahrenden Händler, der regelmäßig die Gegend besuchte. Er brachte Waren, die man bei ihm im März bestellte und zack hatte man sie im November.
An bestimmten „Straßen“ durch Europa entwickelte sich mit der Bildung von Städten ein dichteres Netz von Handel und Warentransport. Einige Städte entstanden auch nur, weil in der Nähe eine Furt oder Brücke einen Fluss querbar machten.
„Zu den Munichen“ – „bei den Mönchen“ – war so eine Stelle. Hier baute man – der Herzog der Länderei- eine Brücke, um die Händler auf diese Fährte zu locken und so an dieser Stelle Pferde und Waren zu tauschen und ZOLL zu kassieren. Angezogen von diesen Möglichkeiten siedeln dort alsbald auch Wirtshaus, Handwerk und weitere Serviceangebote. Eine Ortschaft entsteht und wächst . Heute ist die Stelle an der Brücke international als „Munich“ bekannt… wir sprechen die Stadt jedoch als „München“ aus.
Hier wird die Entstehungsgeschichte genau beschrieben… KLICK.
Noch heute finden sich die Hauptzeugnisse dieser Zeit in den Stadtnamen und Namen von Landschaften. Trägt ein Ort den Wortteil “ Hall „, so weist ihn dies mit Sicherheit des Salzhandels aus. Halle , Bad Hall oder Hall sind Beispiele dafür. Das Wort “ Salz“ tut dies natürlich offensichtlicher und so gibt es auch einige Städte und Gemeinden mit diesem Namensteil.
Die Salzstraße zog sich von den nördlichen und den südlichen Salzerzeugern quer durch Europa

Burghausen liegt an der Salzach, die in den Inn mündet.
Burghausen liegt im Dreieck Passau, München, Salzburg.
Salzhandel ausführlich …
![]()