Eigenschaften der Metalle
Durch die räumliche Anordnung der Atome der Metalle in einem stabilen Gitter , kommt es zu einem Besonderen Verhältnis zwischen den positiv geladenen Atomrümpfen (Atome ohne Außenelektronen) und der großen Anzahl Elektronen (Außenelektronen ) die sich um einen – im Gitter – liegenden Metallatomrumpf befinden.
Der Atomrumpf wird von den Elektronen praktisch umflossen. Und das in 6 Richtungen
(oben, unten, vorn, hinten, rechts und links).
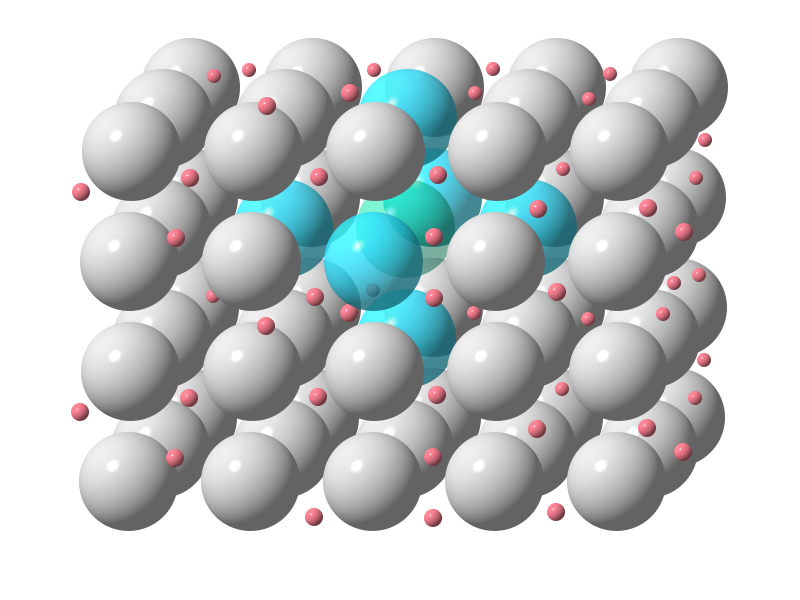
Und dieses System ist in Bewegung. Je wärmer ein Metall ist, desto stärker schwingen die Rümpfe und die Elektronen sind nicht mehr zu einem Rumpf zuzuordnen. Bringt man das Metall zur „Weißglut“ so sind die Bewegungen bei dieser Temperatur so stark, dass die Elektronen ihre Bahnen verlassen. Das sehen wir als Licht. So entsteht durch die Menge an Elektronen der Eindruck des Glühens.
An der Oberfläche eines Metalles erzeugen die sich bewegenden Elektronen einen winzigen Lichtimpuls, der in den oberen Schichten des Metalls reflektiert wird. Dieses Licht erscheint uns als Glanz.
Elektrisch leitfähig bedeutet, Ladungen müssen transportiert werden. Wo, wenn nicht hier wäre das möglich?
Viele, viele frei bewegliche Elektronen in diesem Gitter und das schon bei Raumtemperatur.
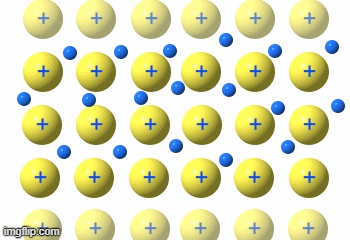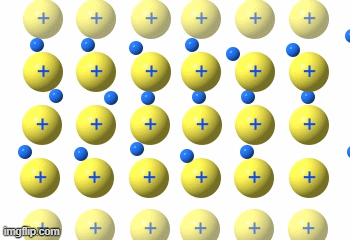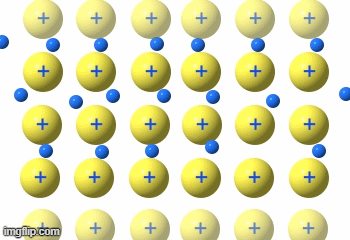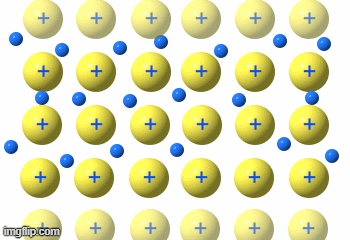
Die Elektronen fließen praktisch durch das Metallgitter.
Die Wärmeleitfähigkeit ist die Möglichkeit Energie also …“Schwingungen“ zu übertagen.
Das funktioniert in einem schwingenden Gitter von Atomrümpfen natürlich hervorragend.
So kann sich Wärme ausbreiten.
Die Verformbarkeit (Duktilität)
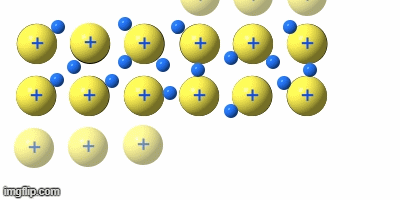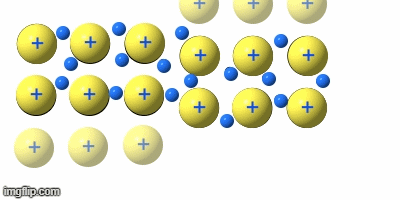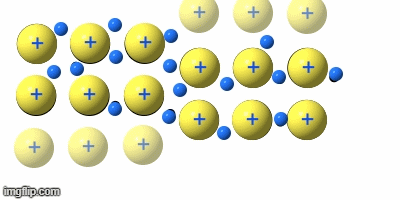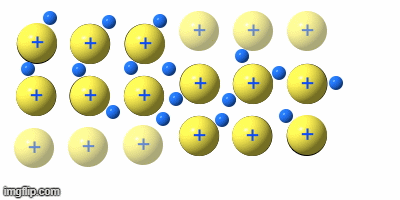
Teile eines Metallgitters können sich verschieben, ohne dass sich die Abstände zwischen den Atomrümpfen großartig ändern, oder es sogar zu Abstoßungskräften durch Annäherung von gleichen Ladungen kommt. Die Rümpfe gleiten aneinander vorbei.
Damit lassen sich Metalle biegen, pressen, walzen …
![]()
