Natriumchlorid – ein Salz

Sprechen wir von Salz, so meinen wir im täglichen Sprachgebrauch fast immer Speise– oder Kochsalz. Natriumchlorid heißt dieses Salz in der Chemie. Es ist das Natriumsalz der Salzsäure oder Chlorwasserstoffsäure.
Seine Formel lautet NaCl, es bildet farblose, feste würfelförmige Kristalle, die uns weiß erscheinen, wenn sie durch Zerkleinern Risse beinhalten.
Kochsalz löst sich gut in Wasser (36g/100ml), ist geruchlos und nicht brennbar.
Wir benötigen ca. 5g Salz am Tag. Wir nutzen Salz zum Würzen unserer Speisen, zur Konservierung von Nahrung und auch zur Enteisung von Straßen im Winter. In medizinischen Präparaten dient es als 0,7% Lösung als kurzzeitiger Blutersatz zur Kreislaufstabilisierung.





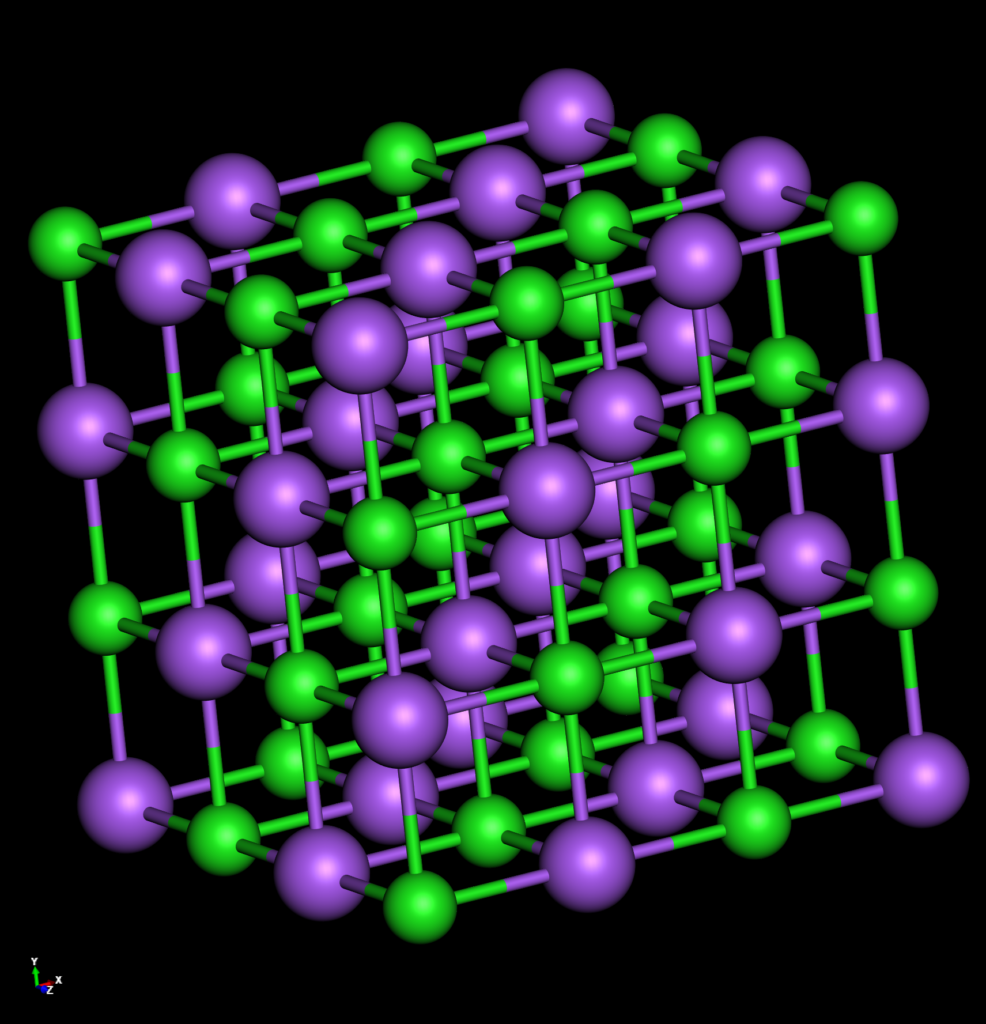
Der Bau von Salz
Salz bildet einen Ionenkristall. Seine Bestandteile sind die Ionen der Elemente Natrium und Chlor. Das positiv geladene Natriumion ist in allen Richtungen (rechts, links, vorn, hinten, oben, unten) von negativ geladenen Chloridionen umgeben. Die Ionen halten durch die vorhandenen Anziehungskräfte (positiv/negativ) und die nebenbei auch entstehenden Abstoßungskräfte einen konstanten Abstand zueinander. Das Mineral NaCl heißt „Halit“ (engl. Halite). und bildet würfelförmige Kristalle, die farblos sind.
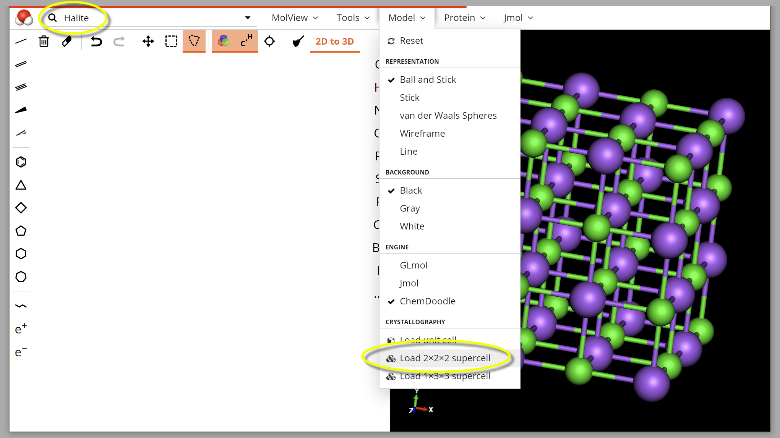
Für eine animierte Version dieser Darstellung gehen Sie folgendermaßen vor:
Geben Sie auf www.molview.org in die Suchzeile „Halite“ein und stellen Sie unter „Model“ die „2x2x2 Celle“ aus.
Das Auflösen von Salz im Wasser
►als Video , Salz lösen (von www.chemie-interaktiv.net)
Wassermoleküle sind ständig in Bewegung. Sie sind sogenannte Dipole. Das bedeutet, ihre Moleküle besitzen positive und negative Ladungsschwerpunkte, die Anziehungskraft auf entgegengesetzt geladene Teilchen ausüben. Das macht Wasser zu einem hervorragenden Lösungsmittel.
Und das immer nach dem gleichen Schema:
1. Die Wassermoleküle dringen in den Ionenkristall ein.
2. Die Kräfte zwischen den Ionen im Gitter werden durch die Ladungs- und Abstandsveränderungen geschwächt.
3. Die Wassermoleküle umlagern die Ionen.
4. Die umlagerten Ionen werden – dank der Eigenbewegung von Wasser- abtransportiert.
Dieser Prozess verläuft endotherm:
Der folgende Inhalt stammt von www.javalab.org
Der „Eis- Salz – Wasser“ Kühlschrank:
Experiment zu „Salze im Lösungsprozessen“ – mit Deutung der Ergebnisse
Arbeitsblätter zum Thema Salz auch im Arbeitsmaterial Klasse 9 :




mehr zum Thema Salz:
Lernprogramm Salz (PC – Download)
Lernbox Salz der Uni Bremen ( Chemie Didaktik )
![]()
