Die Nichtmetalle

Betrachten wir die „andere“ Seite des PSE. Hier finden wir die Elemente „rechts“ der Bor-Astat-Linie.
Die Nichtmetalle sind Atomarten, die Elementsubstanzen aufbauen, die immer etwas „nicht metallisches“ an sich haben. So sind einige gasförmig bei Raumtemperatur oder sie leiten keinen elektrischen Strom, glänzen nicht oder sind schlechte Wärmeleiter. Irgendwas fehlt immer …
Einige Beispiele:
| Eigenschaften / Verwendungen | Kohlenstoff | Schwefel | Phosphor | Stickstoff |
|---|---|---|---|---|
| lateinischer Name/ Namensbedeutung | Carboneum / Holzkohle | Sulfur / langsam brennen, schwelen | Phosphorus /lichttragend, leuchtend | Nitrogenium/ salpeterbildend |
| Bau – Struktur der Modifikationen | Riesenmoleküle Graphit– geschichtet 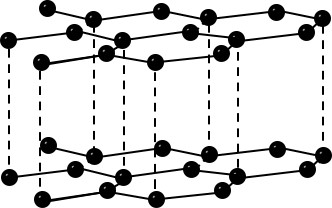 Diamant – Tetraedrisch dicht gepackter Kristall 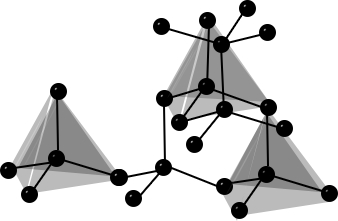 | 8-atomige räumlich orientierte Moleküle 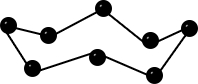 | Moleküle weiß – tetraedrisch 4-atomige Moleküle 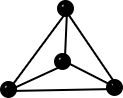 rot/schwarz – gewellte Doppelschichten 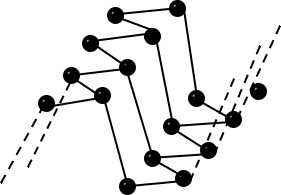 | 2-atomige Moleküle  |
| Dichte (g/cm³) | 2.267 | 2.07 | 1.82 | 1.251 |
| Schmelztemperatur (°C) | 3550 | 115 | 44.2 | -210.1 |
| Siedetemperatur (°C) | 4827 | 444.6 | 280 | -196 |
| Löslichkeit in Wasser | Unlöslich in Wasser | Unlöslich in Wasser, | Unlöslich in Wasser, | Unlöslich in Wasser, |
| Farbe | Schwarz, farblos | Gelb | Weiß, rot, schwarz | Farblos |
| Glanz | Diamant – lichtbrechend Graphit – grau glänzend | nein | nein | nein |
| Geruch | geruchlos | geruchlos | geruchlos | geruchlos |
| Brennbarkeit an der Luft | nicht brennbar | brennbar | brennbar | nicht brennbar |
| elektrische Leitfähigkeit | Graphit – ja Diamant – nein | nein | nein | nein |
| Verformbarkeit in der Kälte | nein | nein | nein | ja (gasförmig) |
| Verwendung | Schmuck (Diamant), Elektroden(Graphit), Kohlenstofffasern Bohr– und Schneidwerkzeuge (Diamant) | Schwefelsäure- und Düngemittelherstellung, | Düngemittel, Feuerwerkskörper, Flammenhemmer | Düngemittel, Kühlmittel, Ammoniakherstellung |
| natürliches Vorkommen | Diamanten- vulkanische Schlote und in Vergesellschaftung mit dem Mineral Kimberlit (Südafrika) | weltweit 1500 Fundorte (Polen, Sizilien,…) | weltweit in Form von Mineralien (Phosphate) | 78,1% der Luft |
Diese Atomarten bilden individuelle Elementsubstanzen von großer natürlicher, biologischer und technischer Bedeutung !
Beitrag: Kohlenstoff
Beitrag: Schwefel
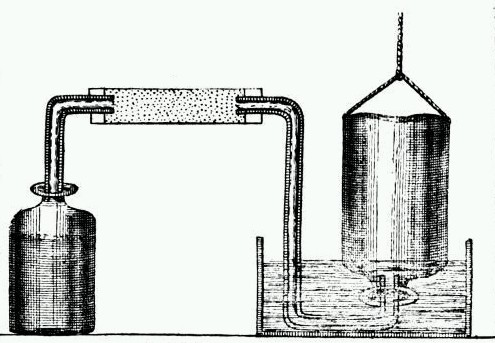
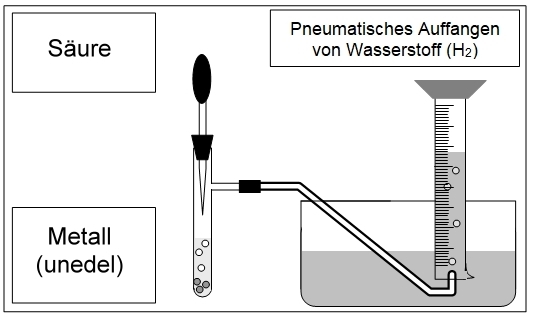
Beitrag: Wasserstoff
Beitrag: Sauerstoff
Beitrag: Phosphor
![]()