Chemische Reaktionen in Natur und Technik
Wir benötigen Grundchemikalien wie Ammoniak, Schwefelsäure, Chlor oder Stahl zu Millionen Tonnen pro Jahr. Diese Stoffe müssen gewonnen, oder produziert werden. Viele Stoffe müssen als Schadstoffe entsorgt oder unschädlich gemacht werden. Allein für die Energiebereitstellung in Form von Wärme oder Elektrizität brauchen wir chemische Prozess ..und das rund um die Uhr.
Grundchemikalien und Werkstoffe
Grundchemikalien und Grundbegriffe zur chem. Reaktion (komplex)
Aufgaben der chemischen Reaktion
Auszug aus dem Arbeitsmaterial: 4 „Arten“ von Reaktionen —Herstellung, Beseitigung…
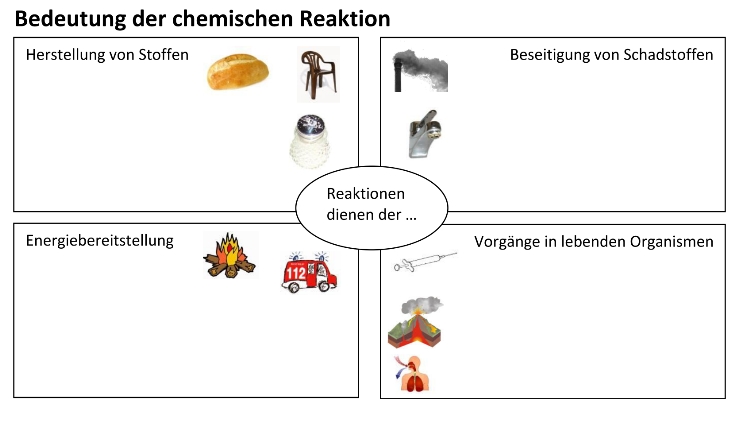
4 „Arten“ von Reaktionen –Lösungsblatt –
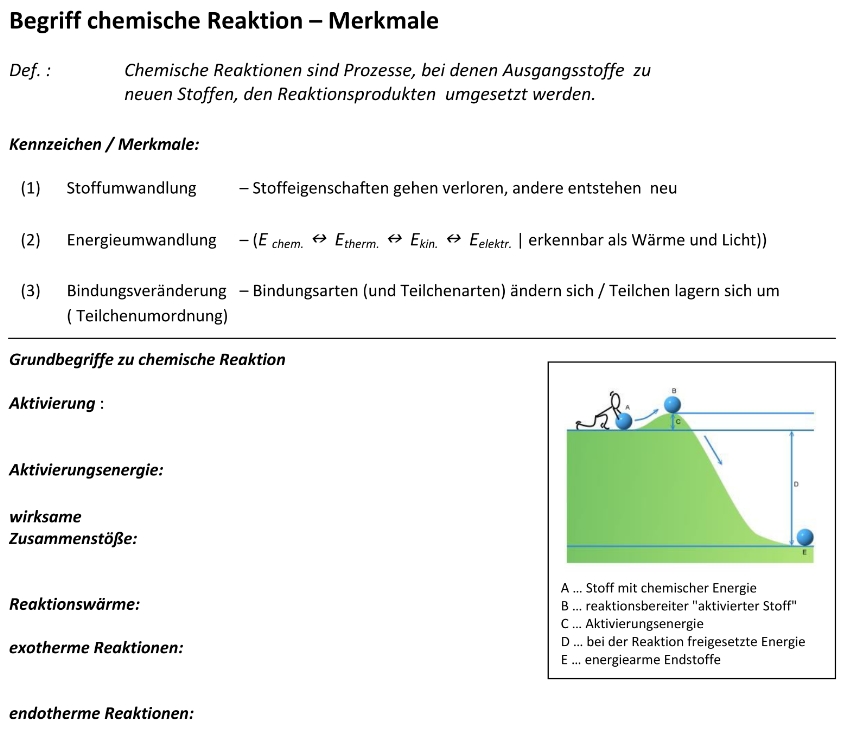
Die chemische Reaktion (Wiederholung)
Auszug aus dem Arbeitsmaterial: chemische Reaktion – Grundbegriffe
PhET-Simulation …zur Demonstration der Modellvorstellung „chemische Reaktion„
VIDEO Aktivierung
VIDEO exotherm/endotherm
Merkmale chemischer Reaktionen üben(Textaufgaben)
Merkmale chemischer Reaktionen üben
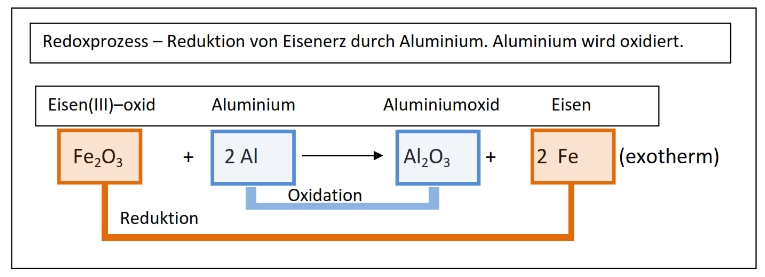
bekannte chemische Reaktionen (Ox-Red-Redox)
Beeinflussung von chemischen Reaktionen
Prozesse wie das Schimmeln oder das Sauerwerden von Milch lassen sich verlangsamen. Dazu kühlen wir die Stoffe. Das verlangsamt die Vermehrung von Keimen, die unsere Lebensmittel unbrauchbar machen.
Auszug aus dem Arbeitsmaterial: Prozesse beeinflussen

PhET-Simulation …zur Demonstration der Modellvorstellung „chemische Reaktion„
VIDEO Telekolleg(Kult)
VIDEO Thiosulfat+Salzsäure
Prozesse beeinflussen Lehrerblatt -Lehrerdemonstration – Experimente
Prozesse beeinflussen als Lesetexte zur Schülerarbeit
Beeinflussung chemischer Reaktionen (komplex)
Der Katalysator
Auszug aus dem Arbeitsmaterial:

Der 3-Wege-Kat im Auto und im LKW
Die Reaktionsgeschwindigkeit
Misst man die Konzentration eines Stoffes, der an der Reaktion beteiligt ist, so stellt man fest, dass die Änderung der Konzentration am Anfang einer Reaktion groß ist und später abnimmt. Die beteiligten reaktiven Teilchen sind am Anfang in Masse vorhanden und es kommt zu vielen gleichzeitigen wirksamen Zusammenstößen. Später ist das nicht mehr so, die Reaktion wird langsamer und kommt zum Stillstand.
Reaktionsgeschwindigkeit — Wie schnell ist eine Reaktion?
Reaktionsgeschwindigkeit — Variante 2
Technische Erzeugung von Grundchemikalien
Grundchemikalien — Ammoniak, Kalk, Schwefelsäure, Stahl
aus Klasse 9: Grundchemikalien-und-WerkstoffeHerunterladen
Ammoniak …zum ausführlichen Beitrag
Ammoniaksynthese 2 Blätter —Das Haber-Bosch-Verfahren (ausführlich)
Simulation einer Haber-Bosch-Anlage (Möglichkeiten der Optimierungen)
VIDEO Ammoniak + Salzsäure
Schwefelsäure
Lesetext: Schwefelsäureherstellung
VIDEO Herstellung und Verwendung (englisch)
VIDEO Herstellung (deutsch)
Schwefelsäure 2 Blätter —Blut der Chemie…ausführlich
weitere Grundchemikalien
Lesetext: Branntkalkherstellung
![]()