Lösen von Stoffen in Wasser – Teilchensimulation
![]()
Chemie kann man üben!

![]()
![]()
gasförmige Alkane
Methan, Ethan,Propan und Butan
Methan CH4
Ethan C2H6
Propan C3H8
Butan C4H10
flüssige Alkane
Pentan, Hexan, Oktan… bis Heptadekan
Pentan C5H12
Hexan C6H14
Heptan C7H16
Oktan C8H18
Nonan C9H20
Dekan C10H22
die ebenfalls flüssigen Undekan C11H24 und Dodekan C12H26 folgen …
Feste Alkane
Oktadekan C18H38
![]()

Schäfer haben mit der Erfahrung vieler Berufsjahre die Fähigkeit durch Clusterzählung ihre Herde auf „Vollzähligkeit“ zu prüfen. Bei Zählungen von bis zu 10.000 Tiere umfassenden Herden in Afrika nutzt man Hubschrauber und erfahrene „Zähler“ oder man fotografiert die Tiere und zählt anschließend am PC…
Man zählt hier also keine Einzelbestandteile, sondern fasst „kleinere Gruppen“ (Cluster) zusammen!
So ähnlich funktioniert das auch in der Chemie…
Aber mal von vorn…
Alle Gase enthalten bei gleichen Bedingungen in einem Volumen dieselbe Anzahl Teilchen.
Diese Erkenntnis verdanken wir Graf Amadeo Avogadro(1776–1856).
Das leichteste Gas ist Wasserstoff!
Stellt man also einem Liter Wasserstoff (0,089g) einen
Liter Sauerstoff (1,429g) gegenüber, so findet man …
$$ \frac{mO}{mH} = \frac{1,429g}{0,089g} = 16,056 $$
Das Sauerstoffteilchen ist 16– mal so schwer wie ein Wasserstoffteilchen.
Später wurden diese Verhältnisse noch genauer bestimmt und heute weiß man
Wasserstoff– und Sauerstoffteilchen stehen im Verhältnis von 1,008 zu 15,999!
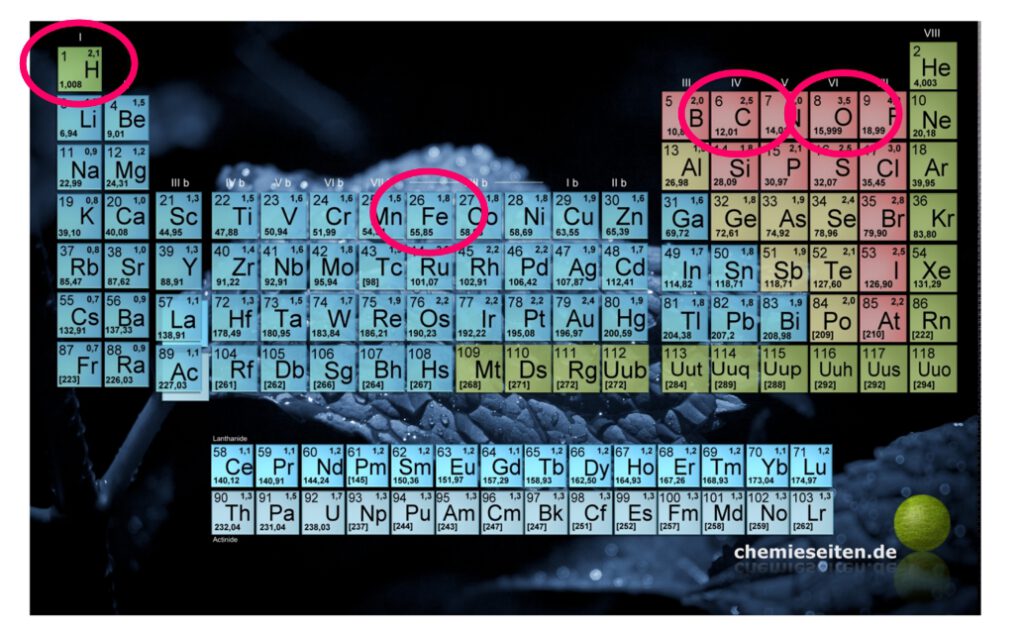
Wendet man dieses Verfahren auf alle verdampften Elemente an, so erhält man eine
Tabelle mit den Atom–Masseverhältnissen, wie im PSE zu sehen (relative Atommasse).
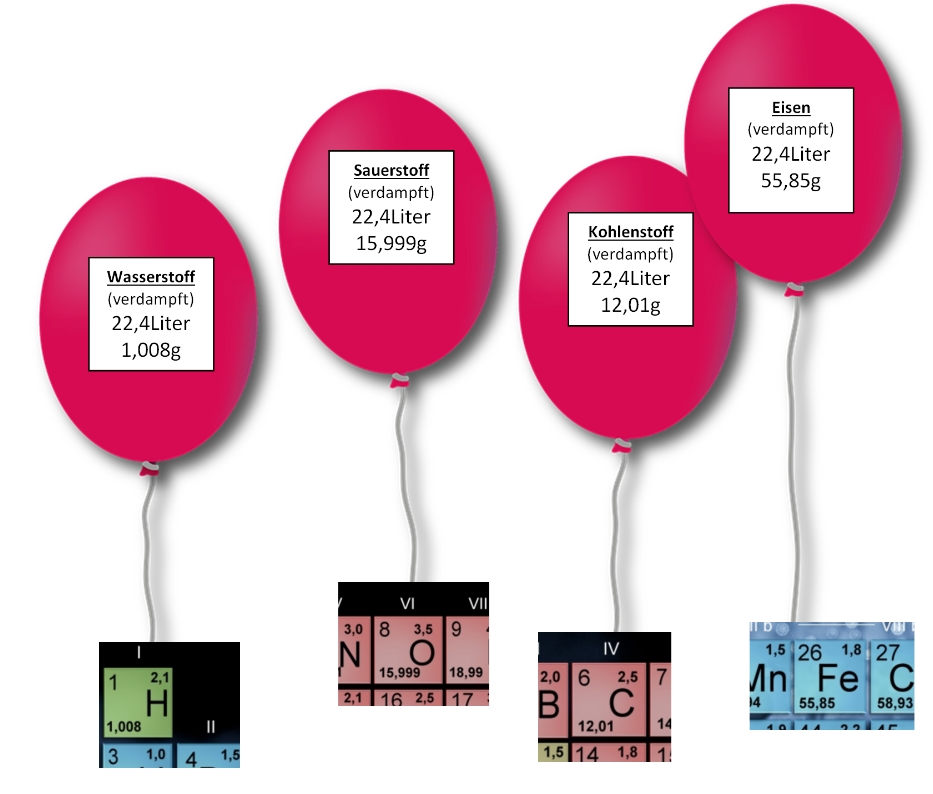
Ein gewisser Herr Josef Loschmidt (1821–1895) fand außerdem heraus, dass Wasserstoff (H2) bei 2g Masse aus genau 6,02214076 ×1023 Teilchen (hier Molekülen) besteht! Diese Vergleichsgröße ist in der Chemie unsere Clusterzahl … wir zählen Stoffe in „mol“, also in 602.214.076.000.000.000.000.000 Teilchen
(»6,022 ×1023), der sogenannten Stoffmenge n.
Weil niemand diese Zahl gern ständig schreibt,
nennt man diese Anzahl Teilchen die
Stoffmenge „ein Mol“!
Uns reicht eine Angabegenauigkeit von 6 ×1023.
1 mol Wasserstoff 1 mol H2 enthält 6 ×1023 Teilchen
6 mol Argon 6 mol Ar enthalten 6 × 6 ×1023 Teilchen
20 mol Eisenoxid 20 mol Fe enthalten 20 × 6 ×1023 Teilchen
4,5 mol Kohlendioxid 4,5 mol CO2 enthalten 4,5 x 6 ×1023 Teilchen
Teilchen heißt.. bei Metallen – Atome, beim Wasserstoff – Moleküle und in einer Verbindung wie Kochsalz (NaCl) – Formeleinheiten
![]()