Hydroxide – Basen

Die Gruppe der Hydroxide wird durch ihren wichtigsten Vertreter – das Natriumhydroxid – bestimmt. Es sind salzähnliche Stoffe – Ionensubstanzen – , die das Hydroxidion \( (OH^- ) \) enthalten.
Allgemeine Eigenschaften: (Gruppenmerkmale)
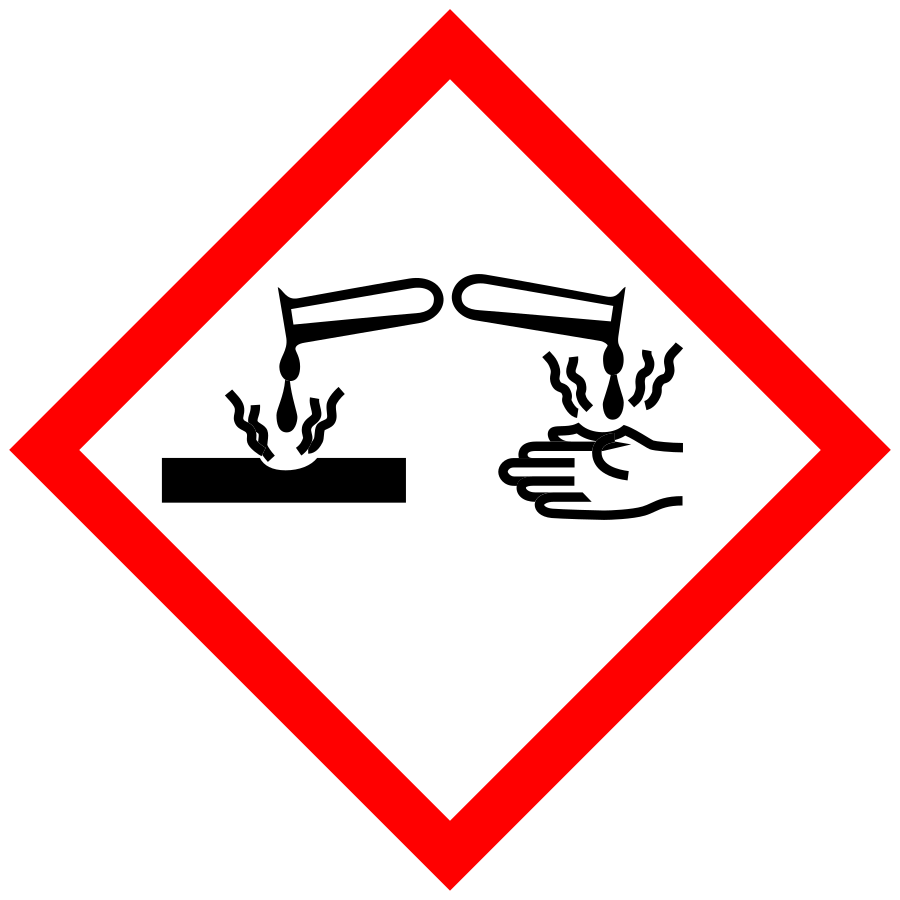
- Basen sind ätzend!
- Basen sind Feststoffe
- gelöste Basen nennt man „Laugen“
- Basen zerfallen in Wasser in ihre Ionen
- Basen enthalten das Hydroxidion, welches auch das Strukturmerkmal der Gruppe ist
- Basen unedler Metalle sind weiß und geruchlos
- Basen aus unedlen Metallen (K, Na, Ca) lösen sich sehr gut in Wasser
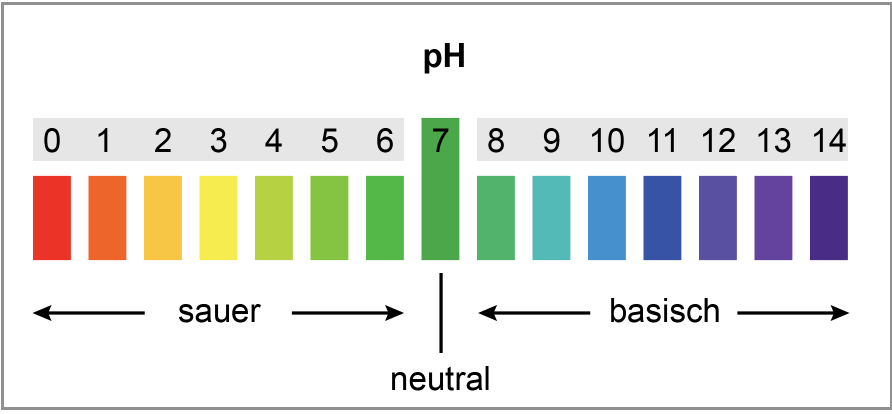
- Basen färben den Indikator UNITEST:“Blau“ (Lackmus-Rot: Blau, Phenolphtalein: rot/pink)
- Basen leiten gelöst und als Schmelze elektrischen Strom
Gut wasserlösliche Basen aus unedlen Metallen. NaOH oder KOH bilden starke, ätzende Laugen. Des weiteren wären Ätzkali (Calciumhydroxid), Magnesiumhydroxid und Aluminiumhydroxid zu nennen, die von medizinischer und bautechnischer Bedeutung sind.
Gebildet werden die Basen (Hydroxide) durch die Reaktion von Metalloxiden mit Wasser:
\( Metalloxid + Wasser –> Metallhydroxid \)
Kaliumhydroxid (KOH) ist Hauptbestandteil von Reinigern für Oberflächen aus Edelstahl in Großküchen oder Anhaftungen und Verkrustungen an Grills und Backöfen. Die Fähigkeit organische Stoffe anzugreifen wird hier ausgenutzt. Das hygroskopische, weiße, feste und sehr gut wasserlösliche Kaliumhydroxid dient weiterhin zur Herstellung von Schmierseifen und Flüssigseifen.
Das weiße, schlecht lösliche Bariumhydroxid \( Ba(OH)_2 \) diente bis ins 18. Jahrhundert zur Herstellung von Eis. Seine Reaktion mit Wasser ist stark endotherm. Das ermöglichte eine Lagerung von Lebensmitteln auch in Gegenden, die ohne den obligatorischen Eiskeller der damaligen Zeit auskommen mussten. Bis heute hingegen nutzt man Bariumhydroxid als Zusatzstoff bei der Herstellung von optischem Glas . Dort sorgt für veränderte Strahlungsdurchlässe in TV-Glasscheiben, Sonnenbrillen und Fensterscheiben. und Im Labor des Chemikers dient es als Barytwasser zum qualitativen Nachweis von Kohlendioxid und Carbonaten.
Magnesiumhydroxid \( Mg(OH)_2 \) kommt in der Natur als Mineral Brucit vor und wird vor allem zur Herstellung von Magnesiumoxid verwendet. In der Medizin findet es als Mittel zur Neutralisation von überschüssiger Magensäure und als leichtes Abführmittel Anwendung. Speiseöl wird es zur Entfernung von Schwefeldioxid zugesetzt. In der Abwassertechnik ist es ein Flockungsmittel. Als Lebensmittelzusatzstoff E 528 wird es Kakaoprodukten zugemischt. Es dient hier als Säureregulator und Aufschlussmittel .
Aluminiumhydroxid \( Al(OH)_3 \) ist das weltweit bedeutendste Flammschutzmittel , es zeigt hierbei eine sehr gute Rauchgasunterdrückung bei niedriger Dichte. Bei über 200°C wird aus dem Mineral Wasser abgespalten. Das feste, weiße und schlecht wasserlösliche salzartige Substrat wird in der Natur im Mineral Bauxit ( AlO(OH) ) als Gibbsit , Bayerit (Türkisbestandteil) und Nordstrandit gefunden. 95% des Bauxits werden jedoch zur Aluminiumproduktion benutzt. Aluminiumhydroxid wird weiterhin zur Ummantelung des Minerals Titanoxid benutzt, welches in Sonnenschutzcremes eingesetzt wird, als Mittel zur Bekämpfung überschüssiger Magensäure, initiiert den Gewebsreiz als Bestandteil von Impfstoffen und darf dort in der EU zu 1250 µg in einer Dosis enthalten sein.
1933 wurde Calciumhydroxid \( Ca(OH)_2 \) als Mineral gefunden und erhielt den Namen Portlandit , wegen seiner Ähnlichkeit zum synthetisch erzeugten Portlandzement. Das Mineral ist selten zu finden und hat deshalb bergbautechnisch keine Bedeutung. Man stellt den dringend benötigten Löschkalk, so heißt die Base, durch das Kalklöschen nach dem Kalkbrennen aus dem dabei entstehenden Produkt Branntkalk CaO her. Das Calciumhydroxid wird nämlich hauptsächlich zur Herstellung von Mörtel verwendet. Wie auch Magnesium- oder Aluminiumhydroxid wird Calciumhydroxid als Mittel gegen überschüssige Magensäure eingesetzt. Weitere Einsatzgebiete sind die Zahnmedizin, wo es zur Desinfektion und zur Anregung der Dentinbildung eingesetzt wird. Als Säureregulator in der Lebensmittelindustrie ( E 526 ) und es entfernt als Atemkalk das Kohlendioxid aus Narkose- und Atemgeräten.
![]()