Kategorie: Klasse 8
Die Edelgase

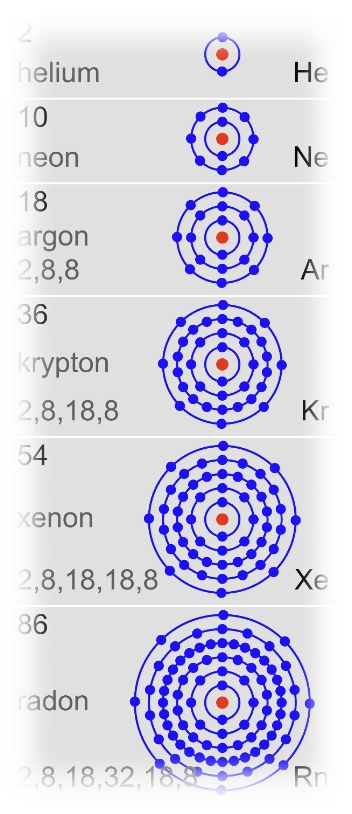
Die Elemente der 8. Hauptgruppe werden als Edelgase bezeichnet. „Edel“ steht in der Chemie für „reaktionsträge also „nicht reaktiv“. Und so findet man in dieser Gruppe nur Atomarten(Elemente), die eine volle Außenschale besitzen. Solche Atome wirken auf andere Atome nicht bindungswillig, also reaktionsfreudig.
(Schau dir die Atome hier an!)
Die Edelgase kommen atomar in der Luft vor. Der Anteil an Argon (Ar) in der Luft beträgt 0,93%. Das Element ist der drittgrößte Luftbestandteil. Argon ist ein farbloses und geruchloses Gas, welches eine leicht höhere aber doch vergleichbare Dichte (1,73 \( \frac{g}{cm^3} \) ) wie Luft hat. Argon wird wie andere Inertgase zur Verhinderung von Reaktionen von Werkstoffen mit der Umgebungsluft eingesetzt. Das Schweißen unter Schutzgas ist neben der Verwendung als Füllgas für Glühbirnen ein weiteres Beispiel dafür.
Mehr Informationen und Steckbriefe zu den Edelgasen findest Du auf www.lernhelfer.de
![]()
Die Halogene
Die Elemente der 7. Hauptgruppe werden Halogene genannt. Das ist griechisch und bedeutet Salzbildner. Diese Elemente haben in ihrem Atombau eine Gemeinsamkeit, die sie auch chemisch sehr ähnlich macht. Sie besitzen eine mit 7 Elektronen gefüllte Außenschale. Das bedeutet, sie benötigen nur noch ein Elektron, um den „Edelgaszustand“ (volle Außenschale) zu erreichen. Diese Atom ziehen fremde Außenelektronen sehr stark an. Das macht sie hoch reaktiv!
Die Halogene bilden durch Aufnahme eines fremden Elektrons einfach negativ geladene Ionen, die „Halogenidionen“. Dazu gehören das Fluoridion \( (F^- ) \) , Chloridion \( ( Cl^-) \) , Iodidion \( (I^-) \) und das Bromidion \( (Br^-) \). Astat ähnelt in seinem chemischen Verhalten dem Element Iod.
Die Halogene sind, wie oben erwähnt, auf Grund ihrer hohen Anziehungskräfte gegenüber fremden Elektronen – Elektronegativität genannt – sehr reaktiv. Freie Halogene reagieren sofort und heftig mit den meisten Stoffen (Ausnahme: Edelgase). In der Natur findet man sie nur in ihren Verbindungen, die meist zu den Salzen gehören.
Bildquelle: www.javalab.org , Der Link führt zum animierten PSE!
Einige Reaktionen von Chlor:
Hier reagiert Chlor mit einigen Metallen:
Reaktion von Chlor, Brom und Iod mit dem unedlen(reaktiven) Metall Natrium:
Gute Steckbriefe und weitere Informationen zu den Halogenen findest Du hier: www.lernhelfer.de
![]()
chemische Reaktionen der Stoffgruppen – Systematisierungsversuche
Ja, hier fehlen einige Reaktionsgleichungen! Frohes Schaffen!
Übungen zu den Stoffgruppen und eine Übersicht (Mindmap) zu den behandelten Stoffgruppen gibt es hier und im Arbeitsmaterial Klasse 10 (Ordnung der Stoffe).
![]()
Stoffgemische
Viele der uns umgebenden Stoffe sind Gemische aus mehreren Substanzen. Meerwasser ist beispielsweise eine Mischung aus Wasser und Salzen, ja im Meerwasser sind viele Salze gelöst. Wirbelt man Staub auf, müsste man diese Mischung in der Luft eigentlich Rauch nennen , aber das tut keiner. Ein Eintopf mit vielen Stücken Gemüse und/oder Fleisch würde in der Fachsprache „Aufschlämmung“ heißen. Aber verlange mal einen Nachschlag von der leckeren „Aufschlämmung„…
Wir nutzen das äußere Erscheinungsbild und die Aggregatzustände der vermischten Stoffe, um die Stoffgemische zu benennen und zu klassifizieren.
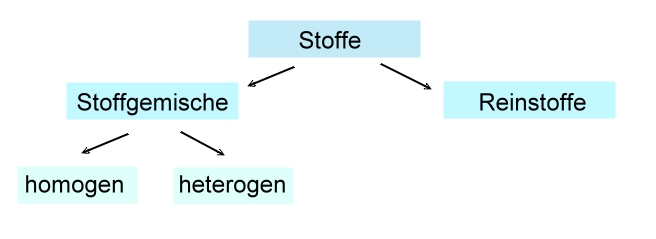
Enthalten Gemische äußerlich auch mikroskopisch unterscheidbare Schichten(Phasen) oder Bereiche, so nennen wir sie „heterogen„. Sind die vermischten Stoffe nach außen jedoch nicht zu unterscheiden – wie in Meerwasser – so nennt man das Gemisch „homogen“.

( ø bis 30 µm , hier vergrößert dargestellt) sind unterschiedlich groß und neigen dazu, sich zu großen Tropfen zu vereinigen. Das Stoffgemisch Milch trennt sich. Es „rahmt auf“ oder „demulgiert“, sagt man. Presst man die Milch jedoch unter Hochdruck durch schmale Düsen oder spritzt sie mit hohem Druck auf Metallplatten, so entstehen in der Milch nur noch winzig kleine Fetttropfen
(ø = 1µm), die die Neigung zu Vereinigung kaum noch besitzen. Somit bleibt die Milch länger im emulgierten Zustand. Diesen Vorgang, bei dem die Milch nach außen weniger unterschiedliche Teilchen aufweist, nennt man „Homogenisieren„.
Auch die metallischen Werkstoffe (Legierungen) werden homogenisiert. Dazu wird das sogenannte Lösungsglühen durchgeführt.
Die speziellere Unterscheidung in die einzelnen Arten von Stoffgemischen geschieht durch die folgende Zuordnung:
„[Aggregatzustand] des beigemischten Stoffes \( \rightarrow \) [Aggregatzustand] des Hauptbestandteil des Gemisches“
Beispiel:
Salzwasser: [fest ]Salz \( \rightarrow \) [flüssig] Wasser …(fest in flüssig)
| beigemischter Stoff in \( \longrightarrow \) | Hauptbestandteil fest | Hauptbestandteil flüssig | Hauptbestandteil gasförmig |
| beigemischter Stoff fest | Gemenge (locker vermischt) (Hülsenfrüchte)  Legierung (innig vermischt) (verschmolzen) (Bronze)  | Lösung (lösliche Beimischung) (Meerwasser)  Aufschlämmung(1) (nicht lösliche Beimischung) (Eintopf)  | Rauch(2) (Weihrauch)  (Vulkanasche)  |
| beigemischter Stoff flüssig | (Teig) | Lösung (lösliche Beimischung) (Säfte ohne Fruchtfleisch)  Emulsion (nicht lösliche Beimischung) (Milch)  | Nebel (2)  (Sprühwolke)  |
| beigemischter Stoff gasförmig | Hartschaum (Schaumstoff)  (Gasbeton)  | Lösung (lösliche Beimischung)  Schaum (nicht lösliche Beimischung)  | Gasgemisch (Luft)  (Schweißgas)  |
Hier die Kurzdefinitionen der wichtigsten Gemische:
Homogene Gemische:
Legierung: inniges Gemisch unterschiedlicher Metalle, die miteinander verschmolzen sind
Lösung: Feststoff, Flüssigkeit oder Gas homogen in einer Flüssigkeit verteilt
Gasgemisch: Gemisch mehrerer Gase
Heterogene Gemische:
Gemenge: lockeres Gemisch mehrerer nicht-mischbarer Feststoffe
Emulsion: Gemisch mehrerer nicht-mischbarer Flüssigkeiten
Nebel: Flüssigkeit verteilt in einem Gas
Rauch: Feststoff verteilt in einem Gas
Schaum: Gas verteilt in einer Flüssigkeit
Hartschaum: Gas verteilt in einem Feststoff
Stoffgemische—Stoffgemischarten und Begriffe
liveworksheets.com
Hier findest du die Erklärungen für die Gemischarten
liveworksheets.com
Arbeitsblatt: Stoffgemische interaktiv 2— Art – Erklärung zuordnen
![]()