Die organische Chemie – Die Kohlenwasserstoffe

1807 prägte Jöns Jacob Berzelius, Professor für Chemie und Pharmazie in Stockholm, den Begriff „Organische Chemie„. Dies geschah im Glauben, dass die Stoffe der lebenden Körper eine übernatürliche Kraft „vis vitalis“ in sich tragen. Niemand würde es je schaffen, Stoffe mit dieser innewohnenden Kraft im Chemielabor zu erschaffen!
1824 gelang die Sensation!
Friedrich Wöhler stellte Oxalsäure her, einen Stoff, der im Rhabarber zu finden ist. Da dies offenbar nicht reichte, synthetisierte er 1828 den vom Menschen produzierten Harnstoff aus einfachen anorganischen Zutaten wie Ammoniak.

Stolz schrieb Wöhler an Berzelius:
„Lieber Herr Professor! Ich kann, so zu sagen, mein chemisches Wasser nicht halten und muss Ihnen sagen, dass ich Harnstoff machen kann, ohne dazu Nieren oder überhaupt ein Tier, sey es Mensch oder Hund, nöthig zu haben… Es bedurfte nun weiter Nichts als einer vergleichenden Untersuchung mit Pisse-Harnstoff, den ich in jeder Hinsicht selbst gemacht hatte.“
Der vollständige Briefwechsel hier!
Damit waren die Weichen für eine neue forschende und auch erzeugende Seite der Chemie gestellt. Es entstanden tausende Produkte wie die Industrie der Farben, Lacke, Waschmittel, Sprengstoffe, Arzneimittel, Kunststoffe und viel mehr!
Die Organische Chemie wird auch die Kohlenstoffchemie genannt.
Sie beschäftigt sich mit den Stoffen und den Prozessen des Lebens!
Video – Einführung in die organische Chemie – Werkstoffkunde
Die Chemie der Kohlenwasserstoffe

Chemische Verbindungen, die aus Kohlenstoff und Wasserstoff bestehen bilden die große Gruppe der Kohlenwasserstoffe (KW). Zu dieser Gruppe gehören ca. 2,5 Millionen bekannte Verbindungen. Sie sind in der Kohlenstoffchemie – der organischen Chemie – beheimatet, die von Antoine Laurent de Lavoisier erstmals beschrieben und von Justus von Liebig und Friedrich Wöhler begründet wurde.
Die große Vielfalt der Kohlenstoffchemie beruht auf der 4-Bindigkeit des Kohlenstoffs. Kohlenstoff kann mit 4 weiteren Atomen eine Verbindung eingehen.
Er bildet ketten- und ringförmige und auch kombinierte Moleküle aus.
Hier das Modell von Methan \( CH_4 \) dem einfachsten Kohlenwasserstoff. Seine Moleküle bestehen nur aus einem Kohlenstoffatom, an das 4 Wasserstoffatome gebunden sind.
Schon der Austausch (die Substitution) dieser Wasserstoffatome liefert eine Großzahl von möglichen neuen Molekülen. Fremdatome wie Sauerstoff, Stickstoff, Schwefel, die Halogene und sogar Metallatome fächern das Repertoire der Möglichkeiten noch weiter auf.hier
Hier wurden 3 Wasserstoffatome durch Chlor ersetzt. Es entsteht Trichlormethan besser bekannt als Chloroform, ein frühes Narkosemittel (Anästhetikum).
Kettenförmige Moleküle kommen beispielsweise im Erdöl vor und können dort über 80 Kohlenstoffatome in einer Reihe aufweisen. Die Bindungswinkel aus dem Methan bleiben erhalten, so entstehen diese seltsamen Kohlenstoffskelette.
Dieser Stoff heißt Tetradekan und gehört zu den höheren Alkanen.
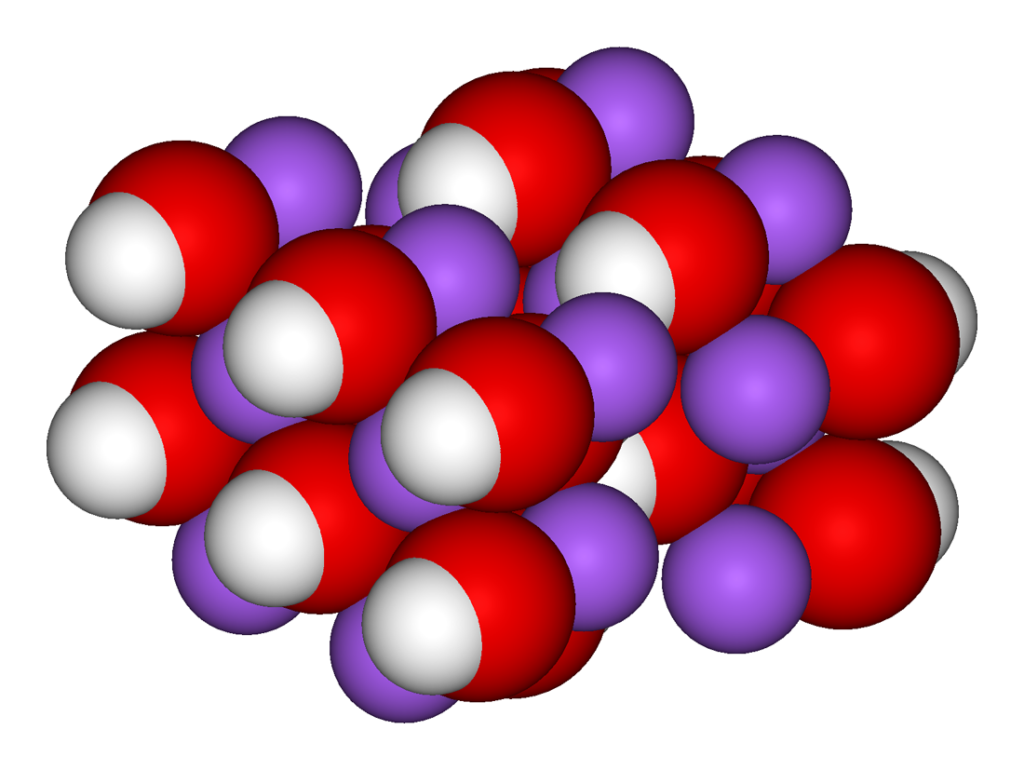
Ringförmige Strukturen findet man natürlich im Erdöl, aber auch in Alltagschemikalien wie Traubenzucker oder unserem Haushaltszucker sind so komplexe Moleküle zu finden.
Das ist das Molekül des Traubenzuckers ( \( C_6 H_{12} O_6 ) \). Die roten Kugeln stellen die Sauerstoffatome dar.
Die Besonderheit ist das Sauerstoffatom als Teil des Kohlenstoffringes.
Die Modelle kann man bei www.molview.org erstellen.
Alle Tiere und Pflanzen bilden solche Stoffe, die wir als Kohlenhydrate, Eiweiße, Fette, Aromastoffe, Düfte oder Enzyme kennen. In der Erdkruste finden wir Erdöl und Erdgas die „fossilen Kohlenwasserstoffe“. Das sind Stoffgemische aus vielen Kohlenwasserstoffen, deren Bestandteile wir zum Beispiel als Benzin oder Diesel nutzen. Aber auch Medikamente, Kunststoffe und viele weitere Produkte werden aus dem „flüssigen Gold“ -wie das Erdöl genannt wird- hergestellt.
![]()