Kunststoffe – Segen und Fluch!
![]()
Chemie kann man üben!

![]()
![]()
Die Herkunft der Kunststoffe:
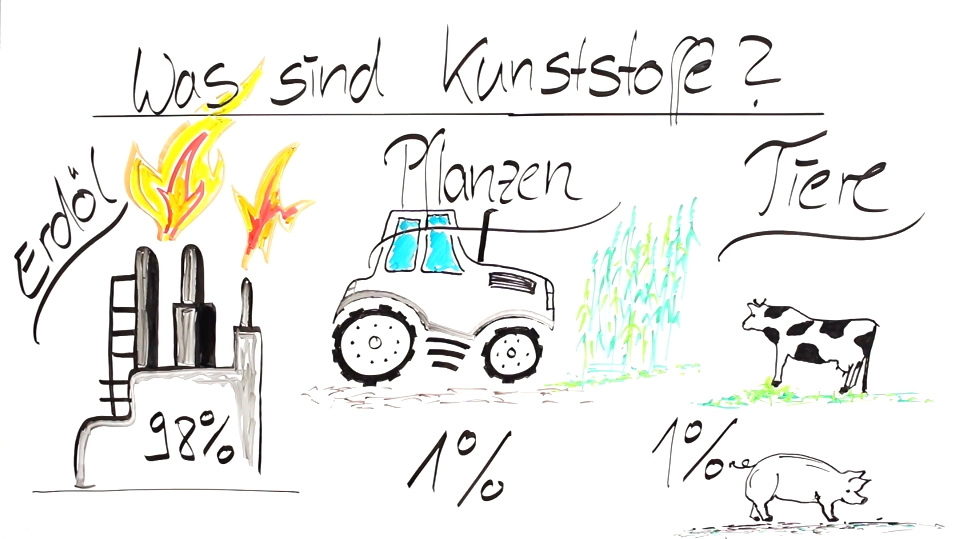
Die Einteilung der Kunststoffe:
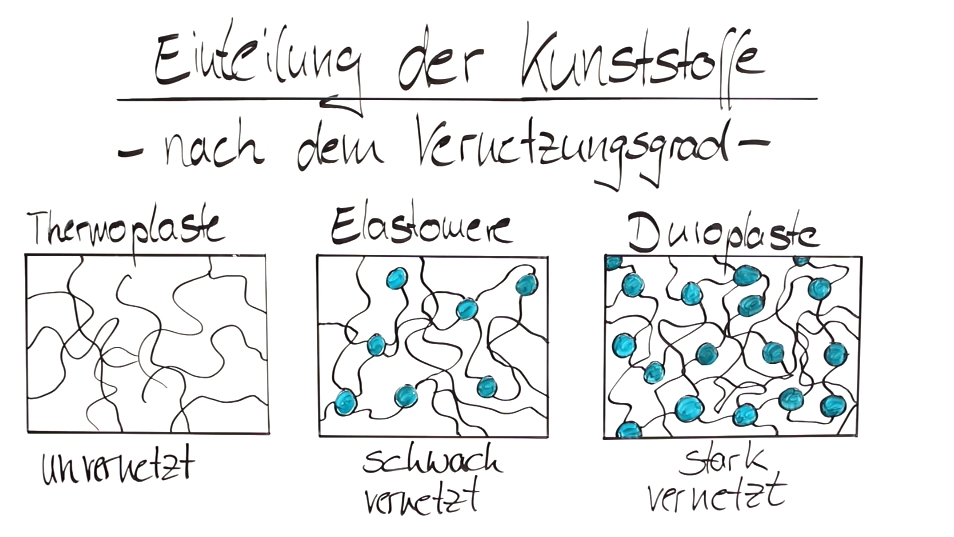
Beide Schemata sind zur besseren Veranschaulichung dem eingebetteten Video entnommen.
Die langen, beinahe unvernetzten Moleküle der Thermoplaste gleiten bei Erwärmung aneinander vorbei, was einen Schmelzbereich ergibt, in dem diese Kunststoffart sehr flexibel verarbeitbar ist (sh. Spritzguss, Extrusion oder Kalandrieren) . Die Elastomere sind nicht nur einfach vernetzt, sondern die langen Molekülketten bilden räumlich gesehen Schlaufen, die man stark deformieren kann. Damit wird die ganze Struktur dieser Art elastisch, sie nimmt also nach einer Verformung den ursprünglichen Zustand wieder an und damit die alte Form. Der Quietsche-Ente Effekt sozusagen. Duroplaste hingegen sind durch ihre starke räumliche Vernetzung ihrer Moleküle starre, unflexible, aber auch stabile, belastbare Kunststoffe, die in Gehäusen von technischen Geräten Verwendung finden.
![]()
Kunststoffe sind aus unserem Leben nicht mehr wegzudenken. An manchen Stellen sollte man sich aber schon fragen, was diese Stoffe dort tun und kann man sie ersetzen? Denn Kunststoffe sind vom natürlichen Kreislauf des Entstehens und Vergehens ausgeschlossen. Sie werden in der Natur nicht abgebaut! In kleinste Teile zerfallen, werden die Kunststoffe als „Mikroplastik“ (1 Millionstel Meter) oder sogar „Nanoplastik“ (ein Milliardstel Meter) von lebenden Organismen (Pflanzen und Tiere) aufgenommen. Wir finden Plastikteilchen im Gewebe von Pinguinen…
Wir finden Kunststoffe inzwischen in:
Haushaltsprodukten
Lebensmitteln
Kosmetika
Beispiele:
Haushaltsprodukte:
Backpapier
ersetzt heute das Einfetten des Backbleches, damit nichts anhaftet. Aber diese Antihaftbeschichtung enthält Silikone. Und die machen das Papier zu einem Produkt mit dem Prädikat „nicht recyclebar“.
Waschmittel
enthalten wasserlösliche und wasserunlösliche Polymere, die sorgen dort zum Beispiel für die Entfernung von Grauschleiern.
Putzmittel
enthalten flüssige Kunststoffe, die als Putzkörper dienen, die die Reibung der Flüssigkeit und damit die Putzkraft erhöhen.
und auch in Kissen, Glitzer, Zigarettenfiltern, Tampons, Textilien und sogar in Toilettenpapier ist Kunststoff enthalten.
Lebensmittel:
Kaugummi bleiben so schön weich , Kaffeefilter und Teebeutel werden reißfester, Bier trübt sich nicht so schnell ein, selbst Schokolade darf eine Verpackung besitzen, die zu 10% in das Produkt übergeht???
Tetrapacks und Konservendosen enthalten innen einen Kunststoffbeutel. Und auch Salz wird uns mit Kunststoffanteil verkauft. Find heraus weshalb!
Kosmetika:
Als Verdickungsmittel oder Putzteilchen sind die Kunststoffe in Zahnpasta und Peelings. Überall da, wo etwas „gehobelt“ also entfernt werden soll, nutzt man all zu gern die Kraft der Plastikkugeln.
Auch als Bindemittel, die den Zusammenhalt im Produkt erhöhen, sind die Kunststoffe im Einsatz.
Sie erhöhen die Reißfestigkeit von Feuchttüchern oder sorgen für Geschmeidigkeit und Glanz beim Eincremen oder Einölen.
Was kann man tun?
Man kann sich informieren und Produkte verweigern ,die man für unsinnig hält.
Wie?
Zum Beispiel mit der Kontrolle der Inhaltsstoffe:
https://www.codecheck.info/
Das geht sogar per App!
![]()