Erdöl
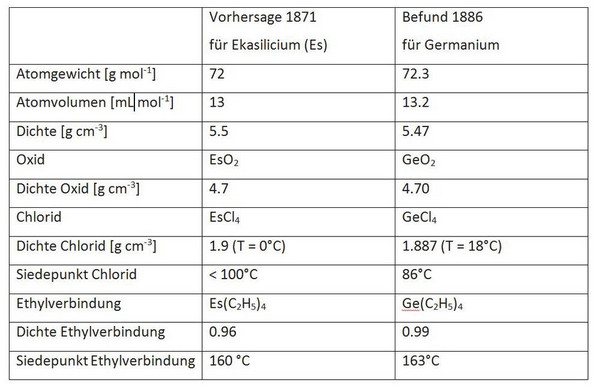
Das flüssige Gold ist auf unserer Erde nur sehr ungleichmäßig verteilt und bedeutet für einen Staat, der darüber verfügt großen Reichtum. Noch vor kaum mehr als 100 Jahren wurde ein russischer Chemieprofessor beauftragt, für den Stoff Erdöl Verwendungsmöglichkeiten zu finden. Er verwies darauf, dass die übel riechende Flüssigkeit wohl nur zum Verbrennen geeignet sei.
Erdöl ist heute DER Rohstoff überhaupt!
Eine Welt ohne Öl? Undenkbar! Noch!
Material
Wechsel zu: Präsentation Erdöl (neuer Tab)
Woraus entstand Erdöl eigentlich? – Entstehung von Erdöl
Anschlussvideo … Entstehung von Erdöl – SWR Video mit anschließender Destillation
Und was macht man daraus?
oder nochmal anders…
…und Entstehung und Destillation in der Kurzvariante
![]()