Die Veredlung von Erdöl

Die Ölvorräte der Erde entsprechen in ihrer Zusammensetzung leider nicht dem industriell- technischen Bedarf. Wir benötigen Unmengen an Diesel- und Benzinkraftstoffe, welche in den Erdölen der Welt nur unzureichend enthalten sind. Dafür sind die Anteile an langkettigen Kohlenwasserstroffen höher als benötigt.
Video – Eine Raffinerie verstehen – von miro-ka.de
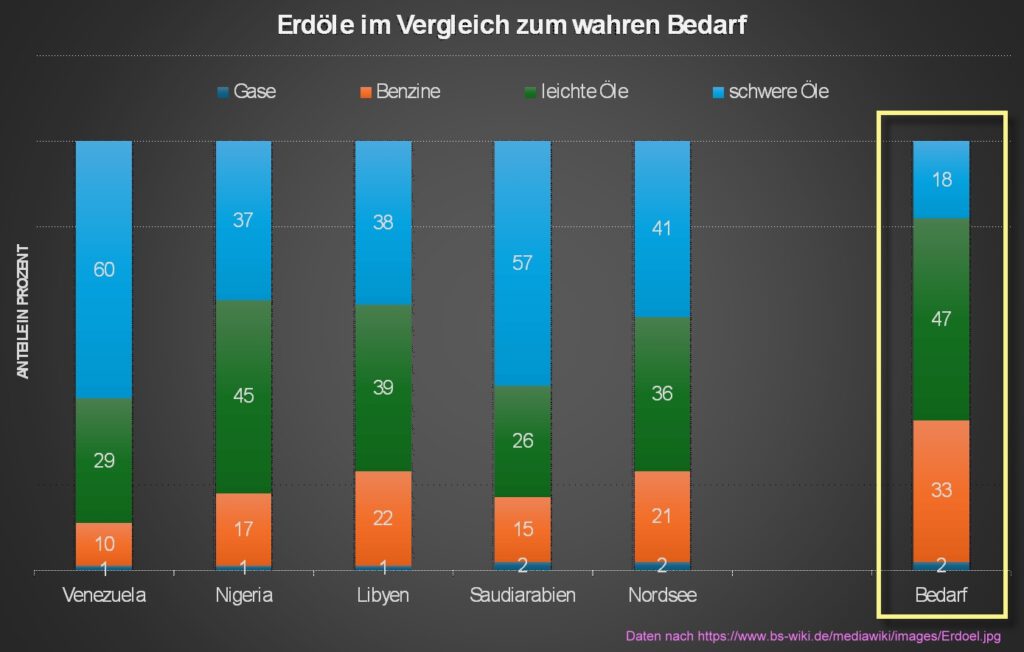
Beispiele für die Zusammensetzung von Erdölen der Welt, verglichen mit dem eigentlichen Bedarf:
Video – Notwendigkeit der Veredlung, Cracken
Daraus ergibt sich die Notwendigkeit, die enthaltenen Fraktionen nachträglich zu optimieren.
Strategie 1 – zu viele lange Kohlenstoffketten – Moleküle aufbrechen – Cracken

Die Fraktionen mit langkettigen Kohlenwasserstoffen z.B. „Schweröle“ werden:
beim „thermischen Cracken“ kurzzeitig auf 700°C bis 900°C erhitzt und so in starke Eigenschwingungen versetzt. Dabei zerbrechen die Moleküle in sehr kurzkettige Moleküle (Ethan, Propan, Butan).
beim „katalytischen Cracken“ bei 450°C über geeignete Katalysatoren wie Molybdänoxid, Wolframoxid, oder Aluminiumoxid geleitet. Die Moleküle zerbrechen in Benzin und Diesel (Hexan, Heptan, Oktan, …, Dodekan).
Beispielgleichung:
\( Hexadekan \rightarrow Oktan + Okten \)
\( C_{16} H_{34} \rightarrow C_{8} H_{18} + C_8 H_{16} \)
Video – Modellversuch „Paraffin- Cracking“
Der hier verwendete „Perlkatalysator“ enthält poröse keramische Kugeln, die an der Oberfläche Aluminiumoxid/Aluminiumsilikat enthalten.
Strategie 2 – zu viel Schwefel stört die Verbrennung – Schwefelgehalt senken

Da Erdöl und so auch seine Fraktionen einen hohen Anteil des Verbrennungs-Störstoffes „Schwefel“ besitzen, ist eine Entschwefelung der Destillate ökologisch(1) und auch ökonomisch(2) unerlässlich. Die Grenzwerte für Schwefel in Erdölprodukten sind heute streng und zwingen so die Industrie zur Entschwefelung.
(1) Schwefel verbrennt zu Schwefeldioxid, einem Umweltgift
(2) Schutz der teuren Auto-Katalysatoren vor aggressivem Schwefel, Minderung der Rußbildung im Dieselmotor
Mit Hilfe von Wasserstoff wird hierbei an einem Katalysator der enthaltene Schwefel in Schwefelwasserstoff umgewandelt (hydriert) und der sogenannten Clausanlage zu elementarem Schwefel umgewandelt.
- Bildung von Schwefelwasserstoff:
\( CH_3 – S – C_{10} H_{21} + 2 H_2 \rightarrow CH_4 +C_{10} H_{22} + H_2 S \) - Umwandlung in Schwefeldioxid:
\( 2 H_2 S + 3 O_2 \rightarrow 2 SO_2 + 2 H_2O \) - Umwandlung in elementaren Schwefel:
\( 2 H_2 S + SO_2 \rightarrow 3 S + 2 H_2O \)
Strategie 3 – verzweigte Stoffe verbrennen „besser“ – Verzweigen, cyclisieren,…

Seitdem Motoren das Kraftstoffgemisch stärker verdichten, ist es dringend notwendig, dass das Gemisch möglichst ideal zündet, also gleichmäßig im Motor verbrennt.
Dabei hat man festgestellt, dass verzweigte also isomerisierte Varianten der Kohlenwasserstoffe(KW) „zündwilliger“ als unverzweigte KW sind. Auch ringförmige KW oder aromatische Varianten der KW (Xylol, u.ä.) sind sehr zündwillig und zeigen weniger zündhemmende Effekte, die mechanische Überbeanspruchungen(„Motorklopfen“) erzeugen.
Die Zündwilligkeit eines Benzins wird als „Oktanzahl“ ausgedrückt. Dabei steht ROZ für „Research-Oktanzahl“. Die „Klopffestigkeit“ eines Motors beschreibt dafür die kontrollierte Zündfähigkeit des Benzingemisches ohne spontane Entzündung auch bei unterschiedlichen Betriebsbedingungen (Drehzahl, Temperatur, Brennraumgeometrie, Verdichtungsverhältnis, Luftdruck, Luftfeuchtigkeit, Zündzeitpunkt, Ablagerungen, usw.) des Motors.
Video – Zeitlupe der Verbrennung im Motorraum
Aus kettenförmigen Kohlenwasserstoffen werden durch Wasserstoffabspaltung cyclische KW, aromatische KW(Mehrfachbindungen) und isomerisierte(verzweigte) KW. ![]() Vollbild -Molekülbetrachtung bei molview.org
Vollbild -Molekülbetrachtung bei molview.org
Die Abbildung zeigt Kohlenwasserstoffe mit 6 Kohlenstoffatomen im Molekül
Hexan – Cyclohexan – Aromat Benzen – Methylpentan(Isohexan)
Arbeitsblatt zum Thema
Mehr erfahren? – Broschüre „Eine Raffinerie stellt sich vor“
![]()

