Das chemische Praktikum
Protokolle und Korrekturvorlagen bei eduki.de kaufen
Siehe auch Arbeitsmaterial Klasse 10
Praktikumseinführung —Ablauf und Regeln
Praktikum I
Charakter einer Lösung , Wiederholung Ionennachweise (Chlorid/Sulfat)
Inhalt des ersten Versuches im Praktikum ist die Identifikation des Charakters einer Lösung. Lösungen können „Sauer“, „Basisch“ oder „Neutral“ sein und das ist vom Vorhandensein eines Überschusses an Wasserstoffionen oder Hydroxidionen abhängig. Diesen Überschuss zeigen Indikatoren wie der Universalindikator UNITEST an.
Auffrischung nötig? Hier gibt es Hilfe zu den „Ionennachweisen„
Protokoll: Praktikum-Experiment 1 — Ionennachweise I . Die Indikatorreaktion
Der Indikator weist das Vorhandensein zweier Ionen nach.
Das Wasserstoffion ( H+) der Säuren und das Hydroxidion (OH–) der Basen
Praktikum II
Ionennachweise – Identifizieren von Stoffen
Treffen in einer Lösung Ionenarten aufeinander, die ein unlösliches oder schwerlösliches Salz bilden, so verbinden diese sich sofort zu einem starken Ionengitter, welches man erst als Trübung der Lösung erkennt und später bei stärkerem Wachstum der Gitter als Flocken, die zu Boden sinken, wahrnimmt.
Dies wird Fällungsreaktion genannt und ist eine anerkannte Nachweismethode für Ionen.
Wir kennen die Nachweise für Chloridionen und Sulfationen.
Auffrischung nötig? Den theoretischen Hintergrund hierfür findest Du hier!
Protokoll: Praktikum-Experiment 2 — Ionennachweise II (sh. Klasse 9)
Der Chloridionen-Nachweis:
Silberionen bilden mit Chloridionen ein schwerlösliches Salz (Silberchlorid).
Ag+ + Cl– ——> AgCl \( \downarrow \)
(der Pfeil nach unten zeigt an, dass der Stoff „ausfällt“ also eine Trübung oder einen Bodensatz verursacht)
Der Sulfationen-Nachweis:
Mit Sulfationen…
und Bariumionen verhält es sich ebenso. Aus diese beiden Ionen bilden starke Anziehungskräfte, die das Wasser nicht überwinden kann. Somit ist auch Bariumsulfat schwer löslich und bildet beobachtbare Niederschläge.
\( Ba^{2+} + SO_4^{2-} \longrightarrow BaSO_4 \downarrow \)
Praktikum III
Gruppenreaktionen – Die Bildung von Säuren und Basen
Metalle und Nichtmetalle reagieren unterschiedlich stark mit Sauerstoff . so kommt es bei den Metallen zum typischen „Rosten“. Auch die Nichtmetalle zeigen diese Reaktion mit Sauerstoff. Allerding ist „Rost“ für die Produkte ein eher untypischer Name. Stoffe, die als Produkte einer Reaktion mit Sauerstoff entstehen, nennt man „Oxide“. Und diese Oxide reagieren mit Wasser. Diese Reaktion ist Gegenstand des dritten Versuches.
Auffrischung nötig? Hier gibt es Hilfe!
Praktikum-Experiment 3 — Gruppenreaktionen ( Me/MeO)
Die Reaktion von Metallen/Metalloxiden mit Wasser und die Reaktion von Nichtmetallen/Nichtmetalloxiden mit Wasser führen zur Bildung von Basen und Säuren.
Metalloxide + Wasser
Nichtmetalle + Wasser
Beispiel: Schwefel
Schwefel verbrennt zu Schwefeldioxid. Dieses stechend riechende Gas wird im Erlenmeyerkolben mit Unitestwasser eingeschlossen. Das sich lösende Gas bewirkt eine Reaktion in Wasser. Der Indikator signalisiert eine Säurebildung!
Es entsteht schweflige Säure!
…und nun noch Kohlendioxid und Wasser (mit Indikator)
In diesem Versuch verwendet der Durchführende „Bromthymolblau“,
einen Indikator mit der folgenden Zuordnung pH-Wert —> Farbskala:

Praktikum IV
Die Neutralisation
Die Reaktion von Säuren mit Basen wird als Neutralisation bezeichnet. Beim Zusammentreffen der Ionen dieser Stoffe finden charakteristische Teilchenumlagerungen statt, die zu den Produkten Salz und Wasser führen. Die typischen Eigenschaften der Ausgangsstoffe verschwinden bei der Reaktion. Diese Reaktionen verlaufen exotherm.
Auffrischung nötig? Hier gibt es Hilfe!
Praktikum-Experiment 4 — Neutralisation (sh. Klasse 9)
ACHTUNG! Nicht nachmachen!
Wir arbeiten tropfenweise und unter ständigem Rühren!
Praktikum V
Kohlendioxid – Herstellung und Nachweis
Kohlenstoffdioxid oder kurz Kohlendioxid wird von uns durch das Atmen produziert. Unsere Ausatemluft enthält 4% des Gases. Kohlendioxid ist inzwischen zu 0,04% in der Luft enthalten. Die chemischen Reaktionen von Kohlendioxid wie die Herstellung von \( CO_2 \) durch das Spalten eines Carbonates und der Nachweis des Gases (auch in der Ausatemluft) sind Gegenstand dieses Praktikums.
Auffrischung nötig? Hier gibt es Hilfe zu „Carbonat und Herstellung von \( CO_2 \) “ und dem „Nachweis von Kohlendioxid„!
Praktikum-Experiment 5 — Reaktion der Säuren / CO2 – Nachweis
Wir unterscheiden den Nachweis von in Carbonaten gebundenem Kohlendioxid und gasförmigem Kohlendioxid.
Nachweis in der Atemluft mit Barytwasser Ba(OH)2
Nachweis in den Salzen der Kohlensäure (Carbonate) durch CO2-Austreibung mit stärkeren Säuren und Einleitung in Barytwasser Ba(OH)2 oder Kalkwasser Ca(OH)2
Praktikum VI
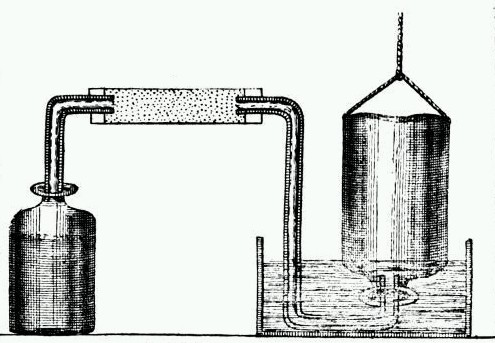
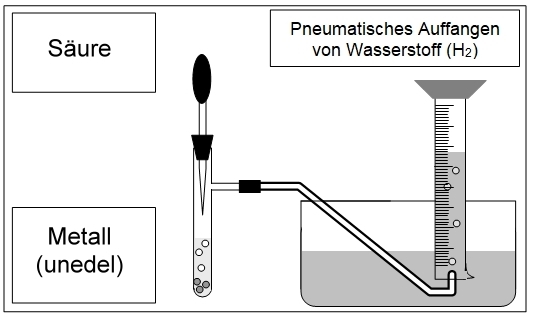
Wasserstoff Herstellung und Nachweis
Wasserstoff ist das häufigste Element des Universums. Diese Atome bilden Moleküle der Formel \( H_2 \). Wasserstoff ist in vielen Verbindungen (Wasser, Säuren, Basen, Kohlenwasserstoffen,…) enthalten und kann aus diesen gewonnen werden. Gegenstand dieses Praktikums ist die Herstellung von Wasserstoff aus einer Säure und sein Nachweis durch die Knallgasprobe.
Praktikum-Experiment 6 — Reaktion der Säuren II / H2 – Nachweis
Herstellen von Wasserstoff
Nachweis von Wasserstoff
Praktikum VII
Nährstoffnachweise
Die Nähstoffe wurden im Lernbereich 1 der Klasse 10 umfangreich besprochen. Die Nachweise für Glucose, Stärke, Eiweiß und Fett sollen hier wiederholt werden.
Auffrischung nötig? Hier gibt es Hilfe!
Praktikum-Experiment 7 — Lebensmitteluntersuchung / Nährstoffnachweise
Glucose
Stärke
Fett
Eiweiß
![]()