Massen an chemischen Reaktionen
Voraussetzung für das Verständnis dieses Artikels ist die Kenntnis der folgenden Grundgesetze der Chemie:
Gesetz von der Erhaltung der Masse
Gesetz der konstanten Proportionen
Gesetz der multiplen Proportionen
Betrachten wir nun die Massenverhältnisse bei chemischen Reaktionen.
Reagiert Eisen (Fe) mit Schwefel (S) , so entsteht Eisensulfid (FeS).

Hier reagieren 1mol Eisen und 1 mol Schwefel zu 1 mol Eisensulfid.
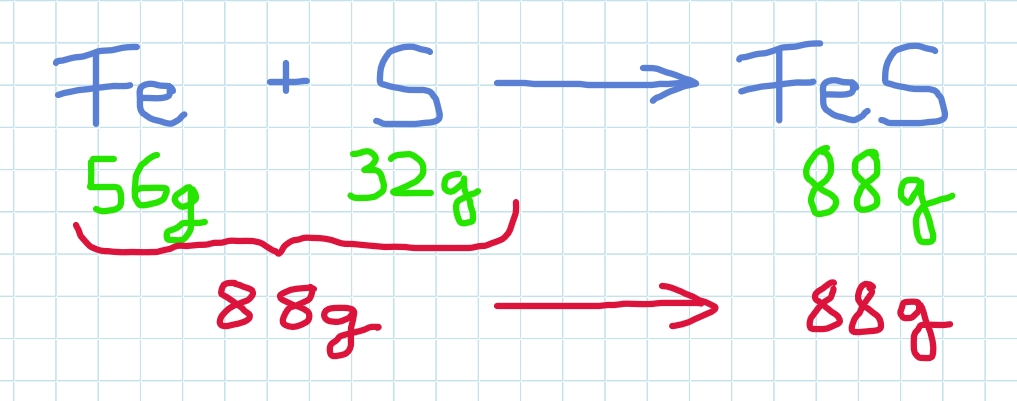
Es gilt lt. Masseerhaltungsgesetz:
Die Masse der Ausgangsstoffe ist gleich der Masse der Reaktionsprodukte!
Die eingesetzten 88g Eisen und Schwefel ergeben 88g Produkt Eisensulfid.
Halbierte man die eingesetzten Massen, so entstünde auch nur halb so viel des Produkts.
Plant man nun nur einen Teil der theoretischen Masse einzusetzen,
so erhält man auch nur einen Anteil der entstehenden Produktmasse.
Welche Masse Eisensulfid entsteht , wenn man nur 10g Eisen einsetzt?
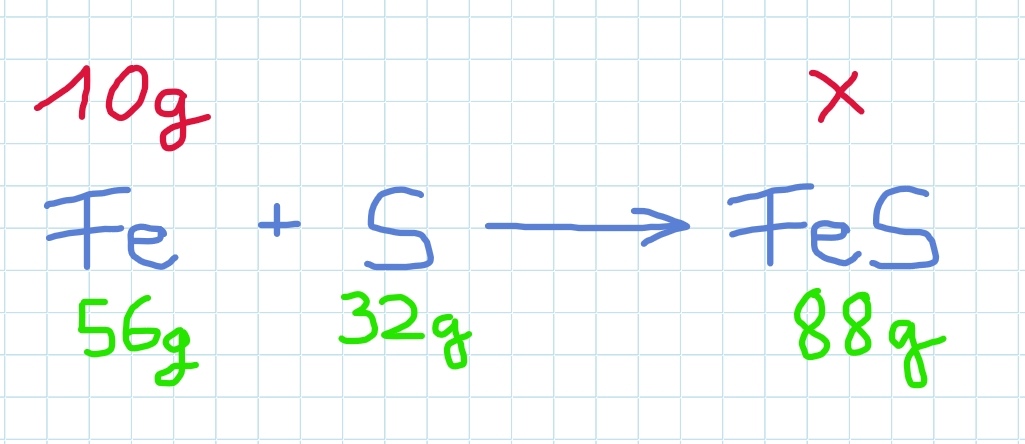
Der Schwefel spielt keine Rolle mehr…
Es entsteht eine Verhältnisgleichung für Eisen und Eisensulfid!

Nach Umstellung nach x ergibt sich…
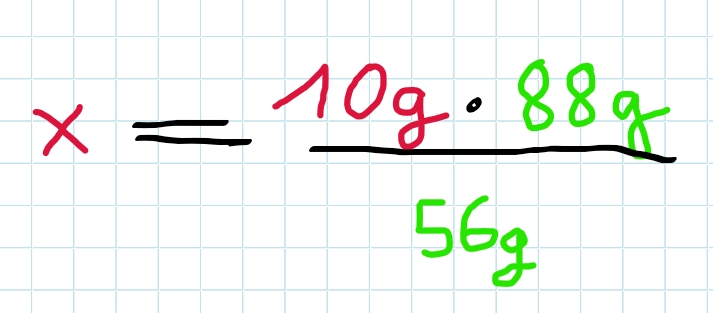
x = 15,714g
Antwortsatz:
Es entstehen also 15,4g Eisensulfid, wenn man 10g Eisen einsetzt.
Die Masse Schwefel, die einzusetzen ist, errechnet sich auf die gleiche Weise.
Ein weiteres Beispiel:
Reagieren Eisenoxid und Kohlenstoff miteinander, so entsteht Eisen und gasförmiges Kohlenstoffdioxid.
Dies geschieht in den hier dargestellten Verhältnissen:

Die einzusetzenden Massen betragen demnach…
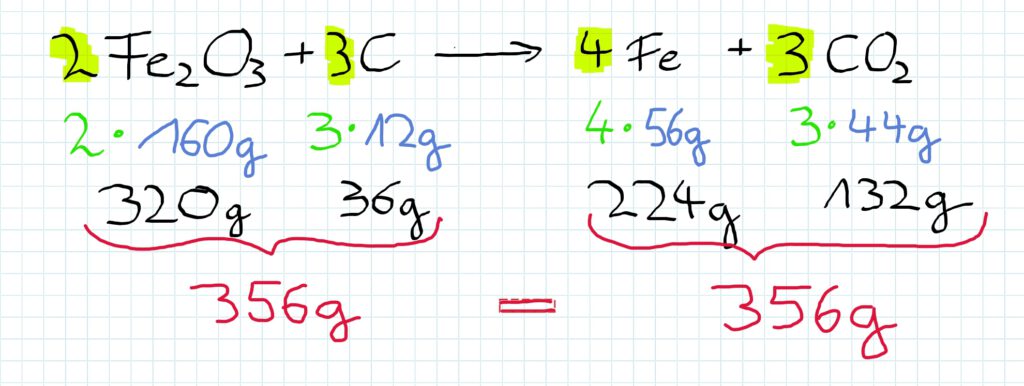
Die Koeffizienten vor den Formeln zeigen, dass ein doppelter oder gar dreifacher Anteil des Stoffes eingesetzt werden muss.
Welche Masse Eisenoxid ist einzusetzen, wenn man 10 kg Eisen produzieren will?
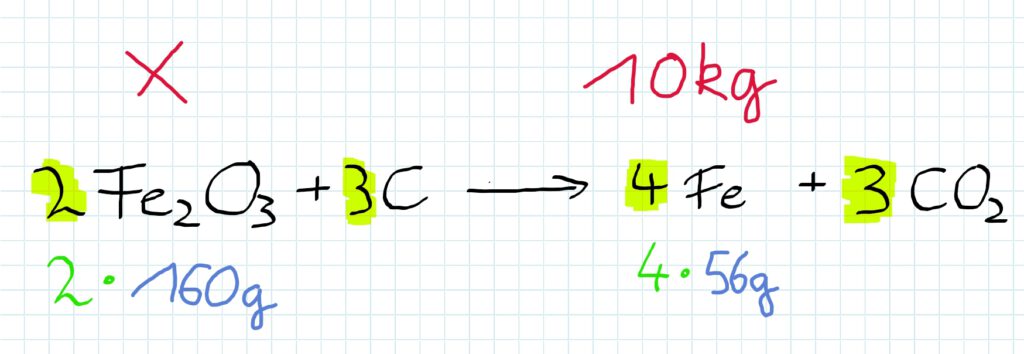
Nun ist nur noch das Verhältnis zwischen Eisenoxid und Eisen interessant…

Dafür ergibt sich die Rechenvorschrift:
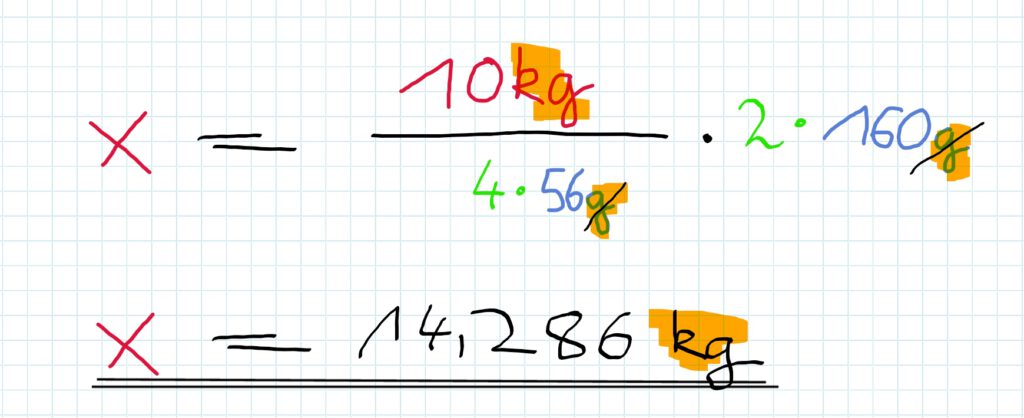
Antwortsatz:
Man muss also 14,286kg Eisenoxid einsetzen, um 120kg Eisen zu produzieren.
![]()