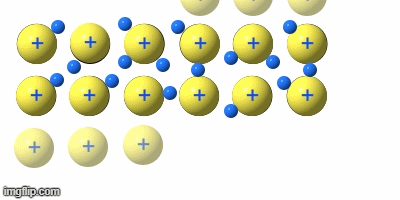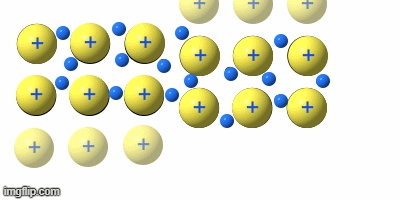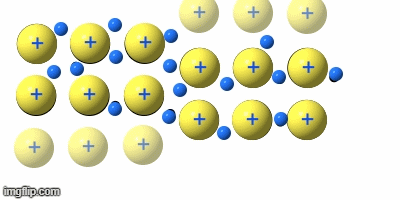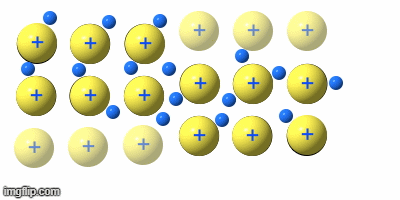
Metalle
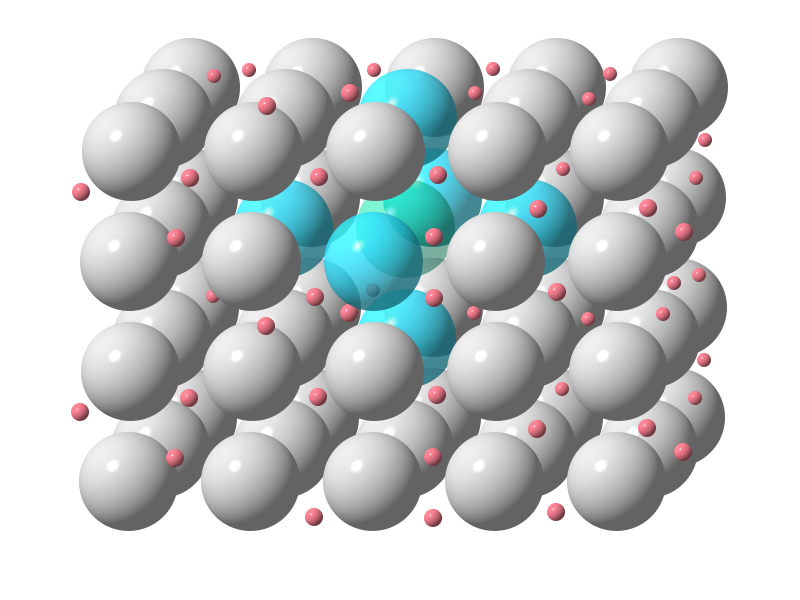
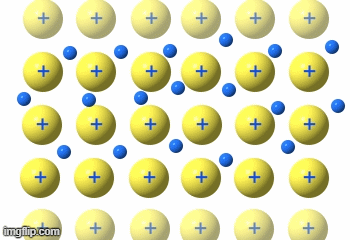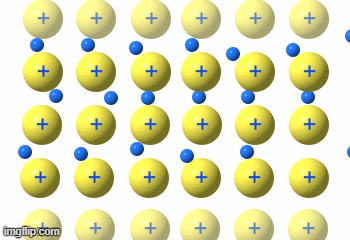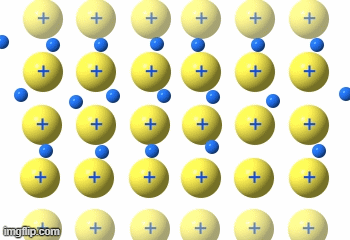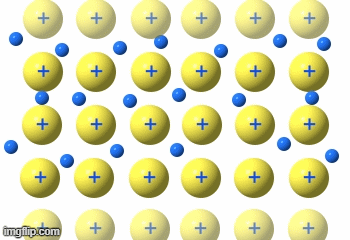
Die Metalle sind eine Gruppe von Reinstoffen, die aus nur einer Atomart(Element) bestehen. Sie sind Elementsubstanzen und bilden eine Gruppe von Stoffen mit sehr ähnlichen Eigenschaften.
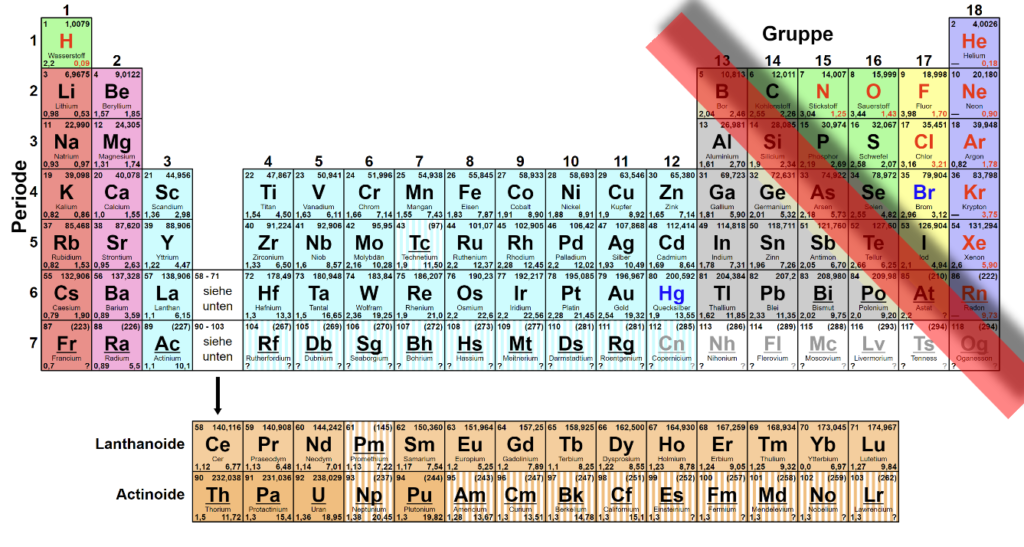
Man findet alle Elemente (Atomarten) systematisch angeordnet im wichtigsten Arbeitsmittel des Chemikers, dem Periodensystem der Elemente (PSE).
Die Metalle findet man links der Bor-Astat-Linie.
Hier werden die Metalle und ihre 4 gemeinsamen Eigenschaften vorgestellt:
Einige Beispiele:
Metalle1—(SSA)Tabelle zu Metallen, HA_Legierung
Magnesium

Joseph Black entdeckte um 1755 Magnesium als Element, 1808 stellte Sir H. Davy Magnesium jedoch zum ersten Mal – durch Amalgamverfahren – dar, großtechnisch wird Magnesium seit 1886 in Deutschland (Schmelzflusselektrolyse von Carnallit) gewonnen. Magnesium leitet den elektrischen Strom nicht so gut wie Aluminium oder Kupfer. In Farbe und Glanz ähnelt es dem Aluminium jedoch sehr. Magnesium ist dehnbar und kann zu Drähten oder Blechen gewalzt und gezogen werden. An der Luft überzieht sich Magnesium mit einer dichten Oxidschicht, die das Metall vor der völligen Zerstörung schützt. Magnesium verbrennt ab Temperaturen von 500°C mit weißer Flamme zu seinem weißen Oxid. In der Natur findet man Magnesium als zentrales Teilchen des Chlorophylls, dem Pflanzengrün. Der Mensch benötigt täglich nur Spuren von Magnesium ( ca. 400mg). Diese nehmen wir aus magnesiumreichen Nahrungsmitteln wie Milch oder Gemüse zu uns. Die geringe Dichte des Metalls ermöglicht gute Verwendungsfähigkeit im Leichtbau. So bestehen Bauteile an Fahrzeugen und Maschinen immer dann aus Magnesium, wenn Gewicht gespart werden muss, hohe Starrheit gefordert ist oder eine gute Korrosionsbeständigkeit gebraucht wird. Mit Aluminium und Silicium entstehen gern eingesetzte leichte Legierungen. Bei der Gewinnung von Uran, Kupfer, Zink und Chrom findet es genau so Anwendung, wie bei der Entschwefelung von Stahlschmelzen.
Aluminium

Aluminium ist als Pulver leicht brennbar uns so Bestandteil von „Silberregen“ im Silvesterfeuerwerk und in Raketentreibstoffen. Das weiche, zähe, hell glänzende, silberweiße Aluminium wird, wie Magnesium und andere unedle Metalle nicht in metallischer Form gefunden, sondern kommt in Verbindungen (Granit, Gneis, Feldspat) vor. Das wichtigste Aluminiummineral heißt Bauxit. Aluminium, das nach seinem Salz Alaun benannt wurde, ist das dritthäufigste Element der Erdkruste. Es reagiert an seiner Oberfläche mit Luft schnell zu seinem glasartigen, harten Oxid und ist so gegen das weitere Verrosten geschützt. Sir Humphrey Davy entdeckte das Metall 1808, konnte es jedoch nicht herstellen. Das gelang Hans Christian Ørsted im Jahr 1825. Dieses „neue“ Metall, was so wundervoll leicht war, wurde zu höheren Preisen als Gold gehandelt. So bekam der König von Siam als Ehrengast bei Napoleon(III) als Einziger das teure Besteck, Napoleon nahm mit Gold vorlieb. Durch verbesserte Herstellungsverfahren verfiel der Preis jedoch rasch. Aluminium wird wie andere Leichtmetalle gern da verwendet, wo es auf jedes Gramm ankommt. In der Luft– und Raumfahrt ebenso, wie bei Leichtbaukonstruktionen für Fahrzeuge, Verpackungen („Alufolie“) und Kochgeschirr und Küchengeräte. Seine guten Leitungseigenschaften machten es in der Elektro– und Wärmetechnik beliebt. In Freileitungen, Kabeln und als Heizkörper findet man es.
Alles über Aluminium (allesueberalu.de)
Recycling von Aluminium
Eisen

Eisen ist neben Kobalt und Nickel eines der nur 3 ferromagnetischen Metalle. Hämoglobin der Blutfarbstoff, enthält Eisen, dieses Metall ist an wichtigen Lebensprozessen wie dem Sauerstofftransport unmittelbar beteiligt und wir müssen Eisen immer wieder mit unserer Nahrung aufnehmen, beispielsweise weil täglich neues Blut gebildet wird. Keine Angst, Eisen ist in vielen Lebensmitteln enthalten. Reich an Eisen sind Haferflocken, Weizenvollkorn, Salate, Erbsen, Nüsse, Bohnen oder Broccoli. Obwohl die Menschen das silbrig glänzende Eisen schon seit langer Zeit verwenden, ist ein 5000 Jahre alter Dolch aus Meteoreisen das älteste Beweisstück für die Bearbeitung dieses Metalls. Eisen, das als Pulver übrigens leicht entzündlich ist, rostet zerstörend. Seine rotbraune Rostschicht ist porös und brüchig, so fällt so nach und nach das ganze Metall dem „Fraß“ zum Opfer. Das funktioniert an feuchter Luft am besten, leider. Dies macht Eisen für viele Einsatzgebiet unbrauchbar. Niemand möchte rostige Kochtöpfe, „Bröselschmuck“ oder sich „selbstvernichtende“ Elektrokabel. Die Mischung des Eisens mit anderen Metallen und dem nichtmetallischen Kohlenstoff (ca. 2%) ergibt den Werkstoff, für den die ganze Welt sich interessiert, Stahl. Seine Einsatzgebiete sind fast unbegrenzt. Von Stahlgerüsten in Hochhäusern über die Brückenkonstruktionen dieser Welt bis zum Skalpell des Chirurgen ist Stahl in seinen über 2000 Varianten der beliebteste metallische Werkstoff, aber kein Metall sondern eine Legierung.
Die Untergruppen
Metalle teilt man nach ihrer Dichte in Leicht- und Schwermetalle ein. Dabei wirde eine Dichte von 5g/cm³ angesetzt.
Weiterhin unterteilt man die Gruppe in Edelmetalle und unedle Metalle. Dabei wird auf die unterschideliche Reaktionswilligkeit eingegangen. „Edel“ heiß in der Chemie so viel wie „reaktionsträge“.
Metalle 2—Untergruppen der Metalle
Wozu ein Metall benutzt wird hängt von seiner Verfügbarkeit aber vor allem auch von seinen Eigenschaften ab.
Metalle 3—Eigenschaften bedingen die Verwendung
Beitrag: Die schwimmende Kanonenkugel und LERNPROGRAMM: Metalle
Über den Tellerrand geschaut:
VIDEO Indium
VIDEO Scandium
VIDEO Rubidium
Metalle bei smart-elements.com
Mischt man Metalle mit anderen Elementen (Metalle/Nichtmetalle), so entstehen Legierungen . Stoffgemische mit manchmal völlig überraschenden Eigenschaften. Hier!
Metalle 4—Legierungen
Im LERNPROGRAMM: Metalle findest du auch offline verfügbare Informationen und Erklärungen.
![]()