Kategorie: Stoffgebiet
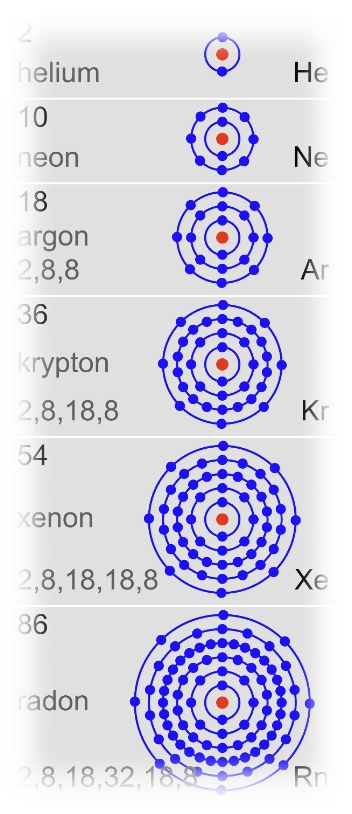
Die Edelgase

Die Elemente der 8. Hauptgruppe werden als Edelgase bezeichnet. „Edel“ steht in der Chemie für „reaktionsträge also „nicht reaktiv“. Und so findet man in dieser Gruppe nur Atomarten(Elemente), die eine volle Außenschale besitzen. Solche Atome wirken auf andere Atome nicht bindungswillig, also reaktionsfreudig.
(Schau dir die Atome hier an!)
Die Edelgase kommen atomar in der Luft vor. Der Anteil an Argon (Ar) in der Luft beträgt 0,93%. Das Element ist der drittgrößte Luftbestandteil. Argon ist ein farbloses und geruchloses Gas, welches eine leicht höhere aber doch vergleichbare Dichte (1,73 \( \frac{g}{cm^3} \) ) wie Luft hat. Argon wird wie andere Inertgase zur Verhinderung von Reaktionen von Werkstoffen mit der Umgebungsluft eingesetzt. Das Schweißen unter Schutzgas ist neben der Verwendung als Füllgas für Glühbirnen ein weiteres Beispiel dafür.
Mehr Informationen und Steckbriefe zu den Edelgasen findest Du auf www.lernhelfer.de
![]()
Die Halogene
Die Elemente der 7. Hauptgruppe werden Halogene genannt. Das ist griechisch und bedeutet Salzbildner. Diese Elemente haben in ihrem Atombau eine Gemeinsamkeit, die sie auch chemisch sehr ähnlich macht. Sie besitzen eine mit 7 Elektronen gefüllte Außenschale. Das bedeutet, sie benötigen nur noch ein Elektron, um den „Edelgaszustand“ (volle Außenschale) zu erreichen. Diese Atom ziehen fremde Außenelektronen sehr stark an. Das macht sie hoch reaktiv!
Die Halogene bilden durch Aufnahme eines fremden Elektrons einfach negativ geladene Ionen, die „Halogenidionen“. Dazu gehören das Fluoridion \( (F^- ) \) , Chloridion \( ( Cl^-) \) , Iodidion \( (I^-) \) und das Bromidion \( (Br^-) \). Astat ähnelt in seinem chemischen Verhalten dem Element Iod.
Die Halogene sind, wie oben erwähnt, auf Grund ihrer hohen Anziehungskräfte gegenüber fremden Elektronen – Elektronegativität genannt – sehr reaktiv. Freie Halogene reagieren sofort und heftig mit den meisten Stoffen (Ausnahme: Edelgase). In der Natur findet man sie nur in ihren Verbindungen, die meist zu den Salzen gehören.
Bildquelle: www.javalab.org , Der Link führt zum animierten PSE!
Einige Reaktionen von Chlor:
Hier reagiert Chlor mit einigen Metallen:
Reaktion von Chlor, Brom und Iod mit dem unedlen(reaktiven) Metall Natrium:
Gute Steckbriefe und weitere Informationen zu den Halogenen findest Du hier: www.lernhelfer.de
![]()
chemische Reaktionen der Stoffgruppen – Systematisierungsversuche
Ja, hier fehlen einige Reaktionsgleichungen! Frohes Schaffen!
Übungen zu den Stoffgruppen und eine Übersicht (Mindmap) zu den behandelten Stoffgruppen gibt es hier und im Arbeitsmaterial Klasse 10 (Ordnung der Stoffe).
![]()
Nachweise Molekülsubstanzen (Gase)
Wasserstoff (\( H_2 \) )
Nachweis: Knallgasprobe  Video
Video
Durchführung: Teste ein Gas durch Entzünden!
Dazu ist es wichtig, dass sich der zu testende Stoff im Gefäß vor dem Entzünden mit bis Luft vermischen kann. Dieses Gemisch wird als Knallgas bezeichnet und reagiert explosiv.
1. Halte das Reagenzglas verschlossen mit deinem Daumen mit der Öffnung nach unten in Flammennähe,
dass der Wasserstoff nicht entweichen kann.
2. Entferne den Daumen! (Reagenzglas offen)
3. Nähere dich ruhig der Flamme und erwarte eine deutlich hörbare Verpuffung!
Effekt/Erklärung: Vorhandenes Knallgas reagiert mit deutlich hörbarer Verpuffung. (Knall)
Der hörbare Knall ist das Resultat der großen Detonationsgeschwindigkeit (2820 m/s) dieser Reaktion , die oberhalb der Schallgeschwindigkeit(ca. 340 m/s) liegt.
chemische Gleichung: Oxidation von Wasserstoff
\( 2 H_2 + O_2 \longrightarrow 2 H_2O\)
Sauerstoff ( (\( O_2 \) )
Nachweis: Glimmspanprobe  Video
Video
Durchführung: Teste ein Gas in einem Gefäß durch Eintauchen eines glimmenden Holzspans !
„Hält man einen Holzspan, dessen Flamme … unter Erhalt der Glut gelöscht wurde, glimmend in ein Gefäß mit dem zu überprüfenden Gas, so flammt der glimmende Holzspan bei Anwesenheit höherer Konzentrationen von Sauerstoff auf und brennt wieder.“ [www.wikipedia.org]
Effekt und Erklärung: Der Glimmspan flammt auf. Es bildet sich eine sichtbare Flamme.
Vorhandener Sauerstoff fördert die Verbrennung so, dass aus dem Glimmen wieder eine Flamme wird. In reinem Sauerstoff laufen Oxidationen schneller/heftiger ab.(Aufflammen)
chemische Gleichung: Oxidation des Kohlenstoffs im Holzspan (Wird nicht benötigt!)
\( C + O_2 \longrightarrow CO_2\)
Störung des Versuchs: Lachgas zeigt dieses Verhalten ebenfalls
Kohlenstoffdioxid ( (\( CO_2 \) )
Nachweis: Kalkwasserprobe  Video
Video
Durchführung: Teste ein Gas durch Einleiten in eine Lösung des Nachweismittels!
Leitet man Kohlenstoffdioxid in eine Calciumhydroxidlösung(Kalkwasser) ein, so trübt sich die Lösung weiß.
(Alternativ kann man auch in ein Gefäß mit Kalkwasser durch einen Strohhalm (o.ä.) pusten, um nachzuweisen, dass unsere Ausatemluft Kohlendioxid enthält)
Effekt und Erklärung: Die Flüssigkeit im Gefäß trübt sich weiß, später bildet sich ein Bodensatz.
Eingebrachtes Kohlendioxid reagiert mit dem Calciumhydroxid der Lösung zu Calciumcarbonat. Dieses schwerlösliche Salz der Kohlensäure ist weiß und bildet nach Absinken einen Bodensatz im Gefäß.
chemische Gleichung:
\( Ca(OH)_2 + CO_2 \longrightarrow CaCO_3 + H_2O\)
Calciumhydroxid + Kohlendioxid \( \longrightarrow \) Calciumcarbonat + Wasser
![]()