Der technische Kalkkreislauf
Arbeitsblatt (passend)
![]()
Chemie kann man üben!

Arbeitsblatt (passend)
![]()
Am Anfang einer chemischen Reaktion steht die maximale Anzahl an Teilchen von Ausgangsstoffen (rot und grün) zur Verfügung. Mit Beginn der Reaktion finden sofort viele wirksame (reaktive) Zusammenstöße statt. Es bilden sich viele Reaktionsprodukte(grau).
Gegen Ende der Reaktion stehen nur noch wenige reaktive Teilchen der Ausgangsstoffe zur Verfügung. Die Reaktion zwischen der Teilchen wird langsamer – seltener wirksam – und „endet“.
Diese Anwendung stammt von javalab.org
![]()
…ist eine Art der chemischen Reaktion, bei der ein Stoff mit Sauerstoff reagiert.
Die Oxidation wird in der Chemie auch als Reaktion mit Elektronenabgabe definiert. Dies setzt jedoch die Kenntnis vom Verhalten der Elemente, Ionen oder Moleküle voraus, Stabilität über die Aufnahme oder Abgabe von Elementarteilchen der Außenschale zu regeln.
Lass uns zunächst die Oxidation als Reaktion der Elemente (Metalle/Nichtmetalle) mit Sauerstoff verstehen.
Element + Sauerstoff —> Oxid des Elements
Schwefel + Sauerstoff —> Schwefeloxid
Eisen + Sauerstoff —-> Eisenoxid
Blei + Sauerstoff —-> Bleioxid
Es gibt nur ein Element außer Sauerstoff, dass nicht auf einfachem Wege oxidiert werden kann und das ist Gold.
Willst Du mehr wissen?
Herstellung von Goldoxid
Es bilden sich Oxide!
Dabei unterscheidet man, die schnelle Oxidation, die auch Verbrennung genannt wird und die ->langsame (stille) Oxidation, die man auch Korrosion, Rosten oder Verwittern nennt.
Verbrennt man Magnesium an der Luft, so brennt dies mit einer grellen Lichterscheinung und großer Wärmeentwicklung.
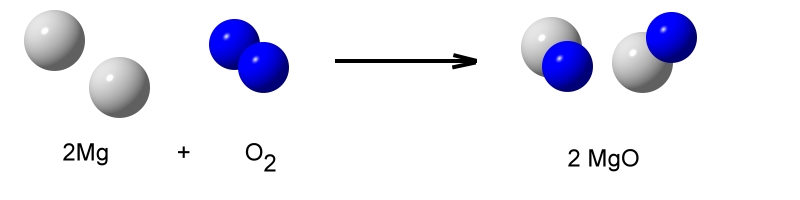
Das weiße Reaktionsprodukt heißt Magnesiumoxid.
Es wird in der Bauindustrie als Bindemittel für Schäume eingesetzt und ist als sogenannter „Säureregulator“ sogar in Lebensmitteln (E 530) als Zusatzstoff (E-Stoff) zugelassen. Auf Grund seines hohen Schmelzpunktes (2800°C) wird es zur Herstellung von feuerfesten Steinen benutzt, die als Auskleidung in Öfen von Laborgeräten oder in Pfannen bei der Stahlherstellung benutzt werden.
weitere Oxidationen:
![]()
Laufen Oxidation und Reduktion in einem System gleichzeitig ab, so nennt man diesen Prozess eine
REDuktions-OXidations –Reaktion oder kurz REDOX –Reaktion.
Voraussetzung ist, es gibt ein Oxid und einen Hilfsstoff, der den Sauerstoff des Oxids aufnehmen kann. So ein Stoff hilft, das Oxid zu reduzieren, er ist ein Reduktionsmittel und wird bei dem Prozess selbst oxidiert. Das Oxid selber ist also ein Oxidationsmittel.
Bei der RED-OX-Reaktion wird ein OXID reduziert und ein Hilfsstoff oxidiert.
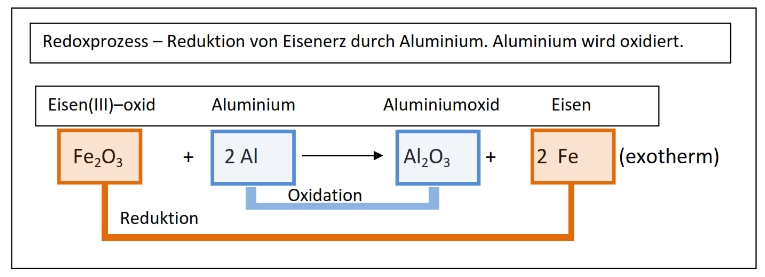
Hier wird Eisenoxid durch Aluminium reduziert. Es entsteht Eisen.
Das Aluminium nimmt dabei den Sauerstoff auf und wird zu Aluminiumoxid oxidiert.
Hans Goldschmidt – Thermitverfahren

Die Versuche des Herrn Hans Goldschmidt zu Redox-Prozessen führten vor über 100 Jahren zu neuen Erkenntnissen in der Metallurgie . Dabei wurden Oxide von stark nachgefragten Metallen, wie Chrom, Mangan und dem Halbmetall Silizium in einer Hochtemperatur-Reaktion aus ihren Oxiden hergestellt.
So stellte Herr Goldschmidt ein Verfahren vor, mit dem es möglich sein sollte, eine gebrochene Eisenbahnschiene innerhalb weniger Arbeitsstunden zu schweißen. Für damalige Verhältnisse undenkbar, da der Austausch der Schiene Tage dauerte und zum „Schweißen“ flüssiger Stahl – also 1800°C heiß – vor Ort sein müsste. Eine Demonstration des Goldschmidtverfahrens fand weltweite Aufmerksamkeit.
Heute wird dieses Verfahren – das „aluminothermische Schweißen“ – weltweit eingesetzt, da es immer noch die einfachste Art ist, flüssigen Stahl in kleinen Portionen an jedem Ort der Welt herzustellen um Schienenstöße miteinander zu verbinden und Reparaturen durchzuführen.
Der Schienenstrang wird von einer Form umgeben und vorgewärmt. Dann wird das Reaktionsgefäß mit dem Eisenoxid- Aluminium – Gemisch aufgesetzt. Die Reaktion des Gemisches wird mit einer Zündkirsche aktiviert und läuft dann stark exotherm von selbst ab. Die Schlacke – das aluminiumoxidhaltige Nebenprodukt – läuft in die seitlichen Schalen. Später wird die Gussform entfernt und die Bruchstelle entgratet.
Weiter zur Eisengewinnung durch den Hochofenprozess…
REDOX-Reaktion von Kupferoxid + Kohlenstoff
![]()
![]()